Кювета со сверхкритическим флюидом
Говорят, что в Японии уже есть самые чистые
прачечные в мире – без сточных вод. Оно и понятно:
Япония – страна маленькая, грязь сливать некуда,
поэтому здесь ценят новейшие научные разработки,
помогающие сохранить окружающую среду. В США
"зеленая химия", в которой нет вредных
растворителей и отходов, тоже переживает
настоящий бум.
А в основе "зеленого" подхода к химии лежит
явление, известное вот уже более столетия. Оно
называется "сверхкритическое состояние
вещества".
Не жидкость и не газ
Из школьного курса физики известны три
агрегатных состояния вещества – жидкое, твердое
и газообразное. Оказывается, это не совсем так. 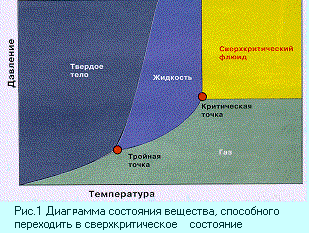 Если
газ сильно сжать, а потом нагреть (рис. 1), то его
плотность скачком увеличится в десятки раз (рис.
2) и окажется близкой к плотности жидкости;
вязкость останется почти как у газа, а самый
главный параметр, который интересует химиков, –
коэффициент диффузии – примет промежуточное для
этих состояний вещества значение. Называть такое
состояние "сверхкритической жидкостью" не
очень удобно, все-таки это нечто среднее между
жидкостью и газом. Поэтому прижился термин
"сверхкритический флюид" от английского fluid,
что означает "способный течь". В
сверхкритическое состояние можно также
перевести жидкость, если она не разложится при
температуре, меньшей критической.
Если
газ сильно сжать, а потом нагреть (рис. 1), то его
плотность скачком увеличится в десятки раз (рис.
2) и окажется близкой к плотности жидкости;
вязкость останется почти как у газа, а самый
главный параметр, который интересует химиков, –
коэффициент диффузии – примет промежуточное для
этих состояний вещества значение. Называть такое
состояние "сверхкритической жидкостью" не
очень удобно, все-таки это нечто среднее между
жидкостью и газом. Поэтому прижился термин
"сверхкритический флюид" от английского fluid,
что означает "способный течь". В
сверхкритическое состояние можно также
перевести жидкость, если она не разложится при
температуре, меньшей критической. 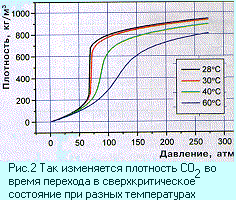
Помимо столь резкого изменения основных
параметров, при переходе от газа к
сверхкритическому флюиду проявляется и еще одна
особенность, свойственная фазовым переходам, –
возникают мощные флуктуации плотности, похожие
на те, что наблюдают в закипающей воде. Это
сказывается на спектре пропускания света – в
момент перехода кювета с флюидом становится
непрозрачной. Если дальше нагревать флюид или
увеличивать давление, то флуктуации будут
уменьшаться, однако совсем не исчезнут.
Область значений температуры и давления, в
которой существует сверхкритический фдюид,
имеет сложную форму. Но для простоты ее, как видно
на рис. 1, обозначают прямоугольником. Левая
нижняя вершина этого прямоугольника называется
критической точкой – это минимальные значения
давления и температуры, необходимые для того,
чтобы газ или жидкость перешли в
сверхкритическое состояние.
Углекислый газ – замечательный растворитель
Сверхкритическое состояние изучено для трех
десятков соединений. Наиболее интересны из них
этан, этилен, пропилен, ксенон, вода, однако,
основное внимание исследователи уделяют сегодня
углекислому газу. В сверхкритическом состоянии
(31оС, 73 атм.) он становится мощным раство
рителем и по отношению к низкомолекулярным
соединениям ведет себя как гексан. С полимерами
– сложнее. При давлении меньше 350 атм. и
температуре до 100оС флюид растворяет
только полидиметилсилоксаны и перфторированные
полиуглеводороды. Причина в том, что молекула СО2,
вступает в специфические взаимодействия с
атомом кремния или фторуглеродной группировкой,
механизм которых до сих пор обсуждается. Если
давление превысит 500 атм., то флюид СО2,
начинает растворять полимеры и других классов.
При этом их растворимость во флюиде достигает
десятков массовых процентов.
То, что перфторированные углеводороды
растворяются в сверхкритическом СО2,
сильно облегчает химикам синтез других
полимеров, например акрилатов. Мономеры
изначально растворимы во флюиде. Однако, едва
зародившись, молекулы полимера норовят выпасть в
осадок. Чтобы их подержать в растворе подольше и
получить полимер с большой молекулярной массой,
нужен "поплавок", которым и служит
фторированный полимер (рис. 3). 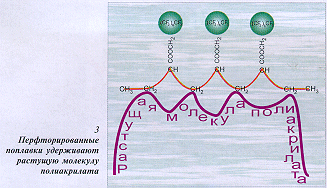 Он одним боком
"зацепляется" за растущий полимер, а
фтор-группами – за флюид, чем и обеспечивает
всему комплексу растворимость.
Он одним боком
"зацепляется" за растущий полимер, а
фтор-группами – за флюид, чем и обеспечивает
всему комплексу растворимость.
Самое главное, что после завершения синтеза
достаточно сбросить давление, и растворитель,
углекислый газ, просто улетит в атмосферу. В
такой схеме синтеза удается избежать главной
беды химической технологии – огромного
количества растворителей, которые приходится
удалять из готового продукта. Более того,
сверхкритическим СО2, можно очистить
готовый продукт от остатков мономера и
инициатора реакции – достаточно промыть
получившийся полимер свежим флюидом. Благодаря
высокой скорости диффузии очищает он легко и
быстро.
Флюид внутри полимера
Если полимер нерастворим во флюиде, это
нестрашно – он может набухнуть. В твердый
полимер удается вводить сверхкритический СО2,
в большом количестве – до 30 массовых процентов. А
это дает выход на другую технологию – получение
микропористых материалов. Полимер помещают в
кювету, заполняют ее углекислым газом и повышают
давление и температуру. При переходе в сверх
критическое состояние флюид пропитывает
полимер, а затем при декомпрессии быстро улетает,
оставляя открытые поры (рис. 4). Так удается
заменить весьма вредные фреоны, которые
применяют для создания пористых материалов. 
Аналогично модифицируют поверхности
полимеров. В этом случае вещество, растворенное
во флюиде, вместе с ним проникает внутрь
полимера. Например, английским ученым удалось на
глубину 4 мм пропитать полиэтилен низкой
плотности модельным веществом – карбонилом
марганца. Ученые из нашего Института
элементоорганических соединений поставили
такой эксперимент. Они ввели в полиарилат
комплексы меди, растворенные в сверхкритическом
СО2, а потом, нагрев его, восстановили медь
до металла. Получился нанокомпозит, в три раза
более устойчивый к истиранию, чем исходный
полимер. Такая методика открывает путь к
получению безызносных материалов. Если же
восстанавливать металл не термически, а
химически, можно сделать стойким к износу
какой-нибудь нетермостойкий полимер, например
полиэтилен.
С помощью флюида в поверхностный слой полимера
удается вводить множество веществ – например,
светостабилизаторы или красители. К сожалению,
подавляющее большинство известных красителей
для полимеров в сверхкритическом СО2,
малорастворимы. Но оптимизм исследователям
придает тот факт, что при соприкосновении с
полимером в него все-таки переходит большая
часть растворенного во флюиде красителя. И уже
подобрали два-три красителя, которые годятся для
органического стекла.
Но наиболее интересно модифицировать
поверхность самого массово го полимера –
полиэтилена. Само по себе это вещество неполярно
и по этому совершено инертно. Чтобы оно могло
взаимодействовать с красителем, клеем или стать
смачиваемым, нужно ввести в его поверхностный
слой вещества с полярными группами, например –
С=О, – NH, – S=O, что и предполагают делать с помощью
сверхкритического флюида.
Очень интересная область использования этой
технологии – создание лекарств с замедленным
действием. Полимер погружают в раствор лекарства
в сверхкритическом СО2, он набухает во
флюиде, и в поверхностный слой легко проникают
большие молекулы лекарства. Но после сброса
давления СО2, быстро улетит, а лекарство
останется. У его молекул малый коэффициент
диффузии, и они будут медленно выходить из
полимера. Зная коэффициент диффузии, можно
рассчитать дозу и сделать препарат с заданным
временем действия.
Очистка и синтез
Третье направление использования –
всевозможная очистка. Раз сверхкритический СО2,
такой сильный растворитель, то почему бы ему не
чистить грязную одежду? И не только ее. Еще в 70-е
годы флюидом научились извлекать из растворов
ионы тяжелых металлов.
В реактор с водой, в которой растворен в виде
соли удаляемый металл, подают сверхкритический
СО2. Но это не чистый флюид – в нем
растворен какой-либо органический лиганд.
Раствор и флюид перемешивают, ион металла
соединяется с лигандом, образует комплекс и
переходит в СО2. Потом флюид вытесняют,
выводят по капилляру за пределы реактора, где
давление падает. Углекислый газ улетает, и
получается металлорганический комплекс в чистом
виде, с которым можно работать дальше.
Таким способом можно извлекать металлы не
только из жидкости, но и из твердого вещества. Во
всяком случае, сейчас в Радиевом институте
(Санкт-Петербург) создают технологию извлечения
из чернобыльской земли заурановых элементов.
СО2 – инертный растворитель, по этому в
нем можно проводить и полимеризацию, и синтез
каких-либо веществ. Но если добавить катализатор,
то СО2 станет реагентом. При этом резко
снижается температура реакции и повышается ее
скорость. Этим воспользовались японские химики,
которые придумали технологию получения
муравьиной кислоты в сверхкритическом флюиде.
Другое дело, которое по степени важности стоит
на втором месте после безотходной химчистки, –
нанесение красок. Сухой краситель растворяется в
потоке сверхкритического СО2, и вместе с
ним вылетает из сопла пистолета. Углекислый газ
сразу же улетает прочь, а краска оседает на
поверхности. На такой метод, которым американцы
собираются в самое ближайшее время красить
автомобили, избавившись от вредных
растворителей, уже получено немало патентов.
Есть и другие флюиды
Все технологии, связанные со сверх критическим
СО2, обьединяет одно: в роли растворителя
выступает газ, входящий в состав атмосферы нашей
планеты. После использования он возвращается
туда же, откуда пришел, не создавая при этом ни
малейшего загрязнения. Таким образом,
сверхкритический флюид из углекислого газа
позволяет избежать загряз ения всеми теми,
крайне неприятно пахнущими и вредными для всего
живого веществами, которыми так славятся
промышленный органический синтез и прочие
химические производства. Но есть и другие флюиды.
Наиболее интересные из них – ксенон и вода.
Вода представляет собой совершенно другой
класс сверхкритических жидкостей. Если у
углекислого и органических газов критические
давления и температуры низкие, то вода
становится флюидом при 374оC и 220 атм.
Работать в этой области температур и давлений
сложно, но зато такая вода растворяет почти все.
Даже сапфировые окошки кювет мутнеют при
длительном использовании.
Одно из важнейших применений сверхкритической
воды – разложение. Если добавить в нее кислород,
то почти все органические вещества за считанные
минуты окисляются до безвредных простейших
составляющих, вроде воды и углекислого газа.
Реакция столь интенсивна, что в воде порой
удается наблюдать пламя. Реакцию ускоряют и
высокое давление, и способность воды вызывать
гидролиз. Такая технология очень полезна для
уничтожения сверх токсичных веществ:
компонентов химического оружия, для очистки
сточных вод от всяческой органики.
Другой интересный флюид – ксенон, который
переходит в сверхкритическое состояние при 17оC
и давлении 57 атм. То есть это вещество не требует
дополнительного нагрева, и исследовательские
установки для него получаются совсем простыми.
Он хорош также как совершенно инертный
растворитель, и в этом качестве его применяют
металлорганики. Сейчас изучение реакций в сверх
критическом ксеноне превратилось в целое
направление.
Тем не менее углекислый газ все таки самый
дешевый, и, видимо, развитие сверхкритической
технологии будет связано именно с ним. Во всяком
случае, подавляющее большинство статей
описывает работу именно в этом сверхкритическом
флюиде. С ним связаны и 90% промышленных
технологий. Например, на первом строящемся
многотоннажном производстве по получению
алифатических фторсодержащих полимеров
компания "Дюпон" собирается применить
именно СО2-технологии.
Лаборатория флюида
В московском Институте элементоорганических
соединений РАН со сверхкритическими флюидами
работают последние пять лет, приготавливая их в
стальной кювете, способной выдержать давление в
500 атм. Главная часть установки – компьютерная
система управления.  А
механическая часть состоит из баллона с
углекислым газом и полости для повышения
давления, связанной стальными капиллярами с
несколькими кюветами (рис. 5). Одна из них –
научная (рис. 6). С ее помощью изучают физику
сверхкри тических жидкостей и отлаживают
систему управления. Здесь стоят датчики
давления, температуры, электрической
проводимости, которая меняется при растворении
вещества во флюиде. Есть и кварцевые микровесы, с
их помощью изучают перераспределение веществ
между флюидом и тонкой полимерной пленкой.
Другая методика – расчет набухания пленки по
дифракционной картинке.
А
механическая часть состоит из баллона с
углекислым газом и полости для повышения
давления, связанной стальными капиллярами с
несколькими кюветами (рис. 5). Одна из них –
научная (рис. 6). С ее помощью изучают физику
сверхкри тических жидкостей и отлаживают
систему управления. Здесь стоят датчики
давления, температуры, электрической
проводимости, которая меняется при растворении
вещества во флюиде. Есть и кварцевые микровесы, с
их помощью изучают перераспределение веществ
между флюидом и тонкой полимерной пленкой.
Другая методика – расчет набухания пленки по
дифракционной картинке.
Две рабочие кюветы объемом око ло 10 см3
сделаны из латуни или нержавеющей стали (рис.
6). В них проводят эксперименты по отработке
сверхкритических технологий – полимеризации, модификации поверхностей,
синтеза различных веществ и их очистке. Если же
надо посмотреть на изменения реагентов в
процессе реакции, то берут кювету с кварцевыми
окошками, ставят ее в спектрофотометр и
фиксируют изменения спектра.
полимеризации, модификации поверхностей,
синтеза различных веществ и их очистке. Если же
надо посмотреть на изменения реагентов в
процессе реакции, то берут кювету с кварцевыми
окошками, ставят ее в спектрофотометр и
фиксируют изменения спектра.
Но для промышленного использования больше
подошел бы проточный реактор. Недавно на
семинаре в Карповском институте профессор
Мартин Полякофф из Ноттингемского университета
(Англия) показывал проточный реактор,
помещающийся в кармане пиджака. В его рабочем
объеме можно получать по нескольку килограмм
вещества за смену.
Про историю флюида
Способность жидкости переходить в некое
"сверхкритическое" состояние ученые
обнаружили в 60-е годы XIX века. Во всяком случае,
именно тогда барон Каньяр де ля Тур рассказал о
таком "особом состоянии", а точку перехода
доктор Эндрюс назвал "критической точкой".
Но прошло более ста лет, прежде чем
сверхкритические флюиды попытались применять на
практике. Сейчас эта технология развивается
очень быстро.
Еще пару лет назад об экологически чистой химии
на основе сверхкритических флюидов рассуждали
на языке теории. Однако уже в этом году на
очередной двухгодичной конференции, которая
состоится в апреле в Атланте, только из
лаборатории лидера в области сверхкритической
полимеризации Жозефа де Симоне (США) заявлено 24
доклада о научных и прикладных направлениях
синтеза полимеров.
В нашей стране судьба сверхкритической
технологии сложилась не просто, и сейчас мы
сильно отстаем от западных коллег. В семидесятых
годах сверхкритические флюиды использовали для
решения проблем, связанных с ядерным оружием и
очисткой радиоактивных веществ. Изучали их и
минералоги, ведь в земной коре на глубине более
километра вода находится в сверхкритическом
состоянии. Чтобы понять, как идет в таких
условиях формирование и растворение пород, в
Институте экспериментальной минералогии
(Черноголовка) строят экспериментальные модели
со сверхкритической водой. Потом, когда
совершенствование ядерного оружие было сочтено
неактуальным, большинство работ закрыли.
Второе дыхание эта технология в нашей стране
обрела совсем недавно, что связано, видимо, с
возросшим интересом к ней на Западе. Сейчас в
Москве действует семинар и есть полтора десятка
лабораторий, которые работают в этом
направлении.
Технологиями, связанными со сверхкритическими
жидкостями, в Институте элементоорганических
соединений РАН занимаются ученые из лаборатории
физической химии полимеров во главе с кандидатом
химических наук
Эрнестом Ефимовичем Саид Галиевым.
Тел. (095)135-05-22,
ernest@pmc.ineos.ac.ru
Зав. лабораторией
член-корреспондент РАН Алексей Ремович Хохлов,
тел. (095)135-50-85.
А семинар можно найти по адресу www.iem.ac.ru/scf
.
 Если
газ сильно сжать, а потом нагреть (рис. 1), то его
плотность скачком увеличится в десятки раз (рис.
2) и окажется близкой к плотности жидкости;
вязкость останется почти как у газа, а самый
главный параметр, который интересует химиков, –
коэффициент диффузии – примет промежуточное для
этих состояний вещества значение. Называть такое
состояние "сверхкритической жидкостью" не
очень удобно, все-таки это нечто среднее между
жидкостью и газом. Поэтому прижился термин
"сверхкритический флюид" от английского fluid,
что означает "способный течь". В
сверхкритическое состояние можно также
перевести жидкость, если она не разложится при
температуре, меньшей критической.
Если
газ сильно сжать, а потом нагреть (рис. 1), то его
плотность скачком увеличится в десятки раз (рис.
2) и окажется близкой к плотности жидкости;
вязкость останется почти как у газа, а самый
главный параметр, который интересует химиков, –
коэффициент диффузии – примет промежуточное для
этих состояний вещества значение. Называть такое
состояние "сверхкритической жидкостью" не
очень удобно, все-таки это нечто среднее между
жидкостью и газом. Поэтому прижился термин
"сверхкритический флюид" от английского fluid,
что означает "способный течь". В
сверхкритическое состояние можно также
перевести жидкость, если она не разложится при
температуре, меньшей критической. 
 Он одним боком
"зацепляется" за растущий полимер, а
фтор-группами – за флюид, чем и обеспечивает
всему комплексу растворимость.
Он одним боком
"зацепляется" за растущий полимер, а
фтор-группами – за флюид, чем и обеспечивает
всему комплексу растворимость. 
 А
механическая часть состоит из баллона с
углекислым газом и полости для повышения
давления, связанной стальными капиллярами с
несколькими кюветами (рис. 5). Одна из них –
научная (рис. 6). С ее помощью изучают физику
сверхкри тических жидкостей и отлаживают
систему управления. Здесь стоят датчики
давления, температуры, электрической
проводимости, которая меняется при растворении
вещества во флюиде. Есть и кварцевые микровесы, с
их помощью изучают перераспределение веществ
между флюидом и тонкой полимерной пленкой.
Другая методика – расчет набухания пленки по
дифракционной картинке.
А
механическая часть состоит из баллона с
углекислым газом и полости для повышения
давления, связанной стальными капиллярами с
несколькими кюветами (рис. 5). Одна из них –
научная (рис. 6). С ее помощью изучают физику
сверхкри тических жидкостей и отлаживают
систему управления. Здесь стоят датчики
давления, температуры, электрической
проводимости, которая меняется при растворении
вещества во флюиде. Есть и кварцевые микровесы, с
их помощью изучают перераспределение веществ
между флюидом и тонкой полимерной пленкой.
Другая методика – расчет набухания пленки по
дифракционной картинке.  полимеризации, модификации поверхностей,
синтеза различных веществ и их очистке. Если же
надо посмотреть на изменения реагентов в
процессе реакции, то берут кювету с кварцевыми
окошками, ставят ее в спектрофотометр и
фиксируют изменения спектра.
полимеризации, модификации поверхностей,
синтеза различных веществ и их очистке. Если же
надо посмотреть на изменения реагентов в
процессе реакции, то берут кювету с кварцевыми
окошками, ставят ее в спектрофотометр и
фиксируют изменения спектра.