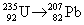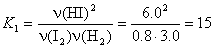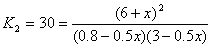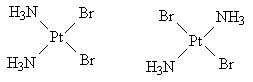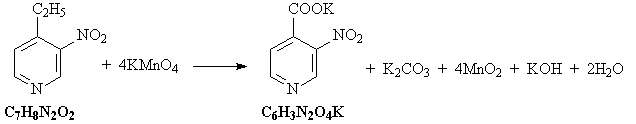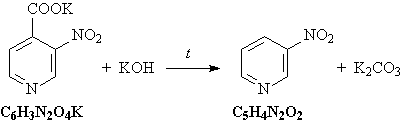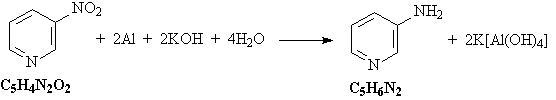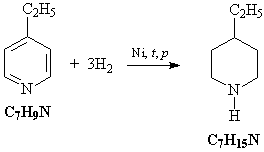|
Новые правила приема
Решения заочного тура
ХИМИЯ
1. Запишем уравнения реакций растворения
цинка в азотной кислоте с образованием отдельно
NO2 и NO.
Zn + 4HNO3 = Zn(NO3)2
+ 2NO2 + 2H2O
3Zn + 8HNO3 = 3Zn(NO3)2
+ 2NO + 4H2O
Для того, чтобы получить мольное соотношение NO2
: NO = 1:3, надо второе уравнение умножить на 3 и
сложить с первым:
10Zn + 28HNO3 = 10Zn(NO3)2
+ 2NO2 + 6NO + 14H2O
Мольное соотношение HNO3 : Zn = 28 : 10 = 2.8 : 1.
Ответ. 2.8 моль HNO3.
2. 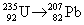
Пусть серия распадов включает x альфа- и y
бета-распадов.
Массовое число меняется только за счет
альфа-распадов: 235 – 4x = 207 x = 7.
Заряд ядра меняется как за счет альфа-, так и за
счет бета-распадов: 92 – 2x + y = 82 y = 4.
Ответ. 7 a,
4 b.
3. Общая формула предельных одноосновных
карбоновых кислот: CnH2nO2.
В молекуле кислоты содержится n + 2n + 2 = 3n
+ 2 атомов.
n(CnH2nO2)
= m / M = 97.5 / (14n + 32) моль.
n(атомов) = (3n + 2)  97.5 / (14n + 32) = 13.0 моль,
97.5 / (14n + 32) = 13.0 моль,
откуда n = 2. Формула кислоты – C2H4O2.
Ответ.C2H4O2.
4. Число вторичных атомов углерода (CH2
групп) не влияет на число четвертичных, т.к. CH2
совпадает с гомологической разностью. Пусть в
молекуле CnH2n+2 содержится x
групп CH3, y групп CH и z четвертичных
атомов C, тогда:
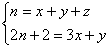
Умножая первую строчку на 2 и вычитая вторую
строчку, находим: z = (x – y)/2 – 1.
Ответ. Число
четвертичных атомов углерода: (x – y)/2 – 1.
5. Смешаем по одному литру растворов NaOH и HBr.
NaOH + HBr = NaBr + H2O.
До реакции: n(NaOH) = 0.04 моль, n(HBr) = 0.02 моль. После реакции: n(NaOH) = 0.04 – 0.02 = 0.02 моль. Объем раствора
после реакции – 2 литра. Молярная концентрация
щелочи: c(NaOH) = 0.02 / 2 = 0.01 моль/л.
NaOH ® Na+ + OH–.
[OH–] = 0.01 моль/л,
[H+] = 10–14 / 0.01 = 10–12 моль/л,
pH = –lg(10–12) = 12.
Ответ.pH = 12.
6. MF + H2SO4(конц) ®
MHSO4 + HF.
2HF + Ca(OH)2 = CaF2 + 2H2O. + 2H2O.
n(CaF2) = 27.3 / 78 = 0.35 моль.
n(MF) = n(HF) = 0.35  2 = 0.7 моль. 2 = 0.7 моль.
M(MF) = 18.2 / 0.7 = 26 г/моль.
A(M) = 26 – 19 = 7 г/моль. Неизвестный металл –
литий.
Ответ. Литий.
7. CnH2n–6®CnH2n–8 + H2.
CnH2n–8
+ Br2® CnH2n–8Br2.
n(CnH2n–8) = n(Br2) = 76 / 160 = 0.475 моль.
В первой реакции: n(CnH2n–6)
= nтеор(CnH2n–8)
= 0.475 / 0.6 = 0.792 моль.
M(CnH2n–6) = 95 / 0.792 = 120 г/моль.
Формула исходного углеводорода – C9H12.
Из восьми гомологов бензола
состава C9H12 отщеплять водород с
образованием двойной связи могут только те, у
которых в боковой цепи есть хотя бы два атома
углерода. Таких изомеров пять:
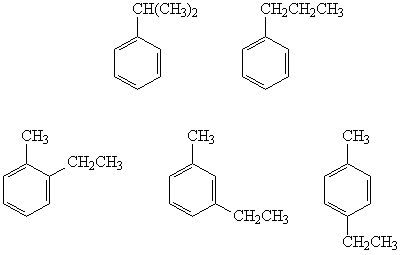
Ответ. Пять изомеров.
8. H2 + I2  2HI 2HI
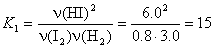
Пусть при охлаждении образовалось еще x
моль HI, тогда израсходовано по x/2 моль H2
и I2:
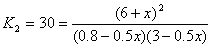
x = 0.55,
n(HI) = 6 + x = 6.55 моль,
n(H2) = 3.0 – x/2 = 2.73 моль,
n(I2) = 0.8 – x/2 = 0.53 моль.
Ответ. 6.55 моль HI, 2.73
моль H2, 0.53 моль I2.
9. Найдем эмпирическую формулу комплекса:
n(Pt) : n(N) : n(Br) : n(H) = (50.13/195) : (7.20/14):
(41.13/80) : (1.54/1) = 1 : 2 : 2: 6
Формула комплекса – PtN2Br2H6,
или [Pt(NH3)2Br2]. Валентность Pt – IV.
Получение:
PtBr2 + 2NH3 = [Pt(NH3)2Br2]
Комплекс имеет форму плоского
четырехугольника с атомом платины в центре.
Одинаковые лиганды могут находиться либо на
одной стороне, либо на диагонали. Геометрические
изомеры:
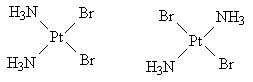
Ответ.[Pt(NH3)2Br2].
Валентность центрального атома IV.
10. Исходное вещество C7H9N – любой
из трех этилпиридинов (орто-, мета- или пара-).
Схема превращений:
C2H5C5H9NH2Cl  C2
H5C5H9NH C2
H5C5H9NH C2H5C5H4N C2H5C5H4N
 C2H5C5H3(NO2)N C2H5C5H3(NO2)N
 KOOCC5H3(NO2)N KOOCC5H3(NO2)N 
 C5H4(NO2)N C5H4(NO2)N C5H4(NH2)N
C5H4(NH2)N
Уравнения реакций:
1) Этилпиридин нитруется под действием азотной
кислоты:
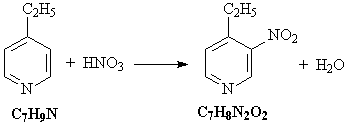
2) При взаимодействии этилпиридина с водным
раствором перманганата калия этильная группа
окисляется:
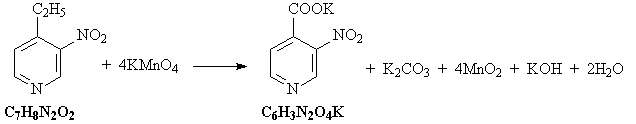
3) При прокаливании соли карбоновой кислоты с
гидроксидом калия происходит
декарбоксилирование:
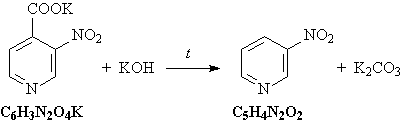
4) Нитрогруппа восстанавливается до
аминогруппы алюминием в щелочной среде:
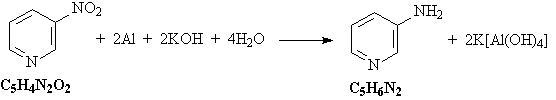
5) Исходное соединение – этилпиридин – можно
прогидрировать водородом на никелевом
катализаторе:
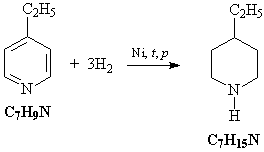
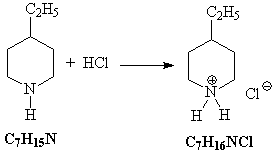
6) Полученный циклический амин присоединяет
хлороводород:
11.В обоих случаях происходит реакция
нейтрализации:
H+ + OH– = H2O.
В первом случае в реакцию вступило по 0.01 0.50
= 5.0 0.50
= 5.0 10–3 моль ионов H+ и OH–
и образовалось столько же моль H2O (на 20 мл
раствора). Во втором случае ионы OH–
находятся в недостатке: в реакцию вступило по 0.005 10–3 моль ионов H+ и OH–
и образовалось столько же моль H2O (на 20 мл
раствора). Во втором случае ионы OH–
находятся в недостатке: в реакцию вступило по 0.005 0.50
= 2.5 0.50
= 2.5 10–3 моль ионов H+ и OH–
и образовалось столько же моль H2O, т.е. в 2
раза меньше, чем в первом случае. В результате
реакции выделилось в 2 раза меньше теплоты, но эта
теплота приходится на меньший объем раствора: 15
мл вместо 20. Понижение температуры во втором
случае: 10–3 моль ионов H+ и OH–
и образовалось столько же моль H2O, т.е. в 2
раза меньше, чем в первом случае. В результате
реакции выделилось в 2 раза меньше теплоты, но эта
теплота приходится на меньший объем раствора: 15
мл вместо 20. Понижение температуры во втором
случае:
DT2
= DT / 2  (20/15) = (2/3) (20/15) = (2/3)  DT. DT.
Ответ. (2/3)  DT. DT.
12. 1) При смешивании растворов хлорида
железа (III) и силиката натрия происходит полный
гидролиз обоих соединений. Если реакцию
проводить при легком нагревании, то образуется
не кремниевая кислота, а ее ангидрид.
2FeCl3 + 3Na2SiO3
+ 3H2O = 2Fe(OH)3 + 3SiO2 + 3SiO2 + 6NaCl.
+ 6NaCl.
2) Гидроксид железа (III) при прокаливании теряет
воду:
2Fe(OH)3 = Fe2O3
+ 3H2O.
3) Оксид железа (III) восстанавливается до металла
под действием углерода:
2Fe2O3 + 3C = 4Fe
+ 3CO2.
4) Углерод также восстанавливает оксид кремния:
SiO2 + C = Si + CO2.
5) Кремний растворяется в щелочах:
Si + 2NaOH + H2O = Na2SiO3
+ 2H2.
6) При действии соляной кислоты на раствор
силиката натрия образуется кремниевая кислота,
которая при легком нагревании переходит в
кремниевый ангидрид:
Na2SiO3 + 2HCl =
SiO2 + 2NaCl + H2O. + 2NaCl + H2O.
Ответ. X1 – Fe(OH)3,
X2 – Fe2O3, X3 – C, Y1 – SiO2,
Y2 – Si, Y3 – Na2SiO3.
13. В реакциях с водой образуются два газа –
водород и аммиак:
BaH2 + 2H2O =
Ba(OH)2 + 2H2,
Li3N + 3H2O =
3LiOH + NH3.
При растворении смеси в соляной кислоте
выделяется только водород:
BaH2 + 2HCl = BaCl2
+ 2H2,
Li3N + 4HCl = 3LiCl + NH4Cl.
Пусть n(BaH2) = x моль, n(Li3N) = y моль, тогда n1(H2,NH3) = 2x + y, n2(H2) = 2x. По условию:
2x + y = 1.5 2x, 2x,
откуда x = y. Исходная смесь –
эквимолярная. Массовая доля гидрида бария:
w(BaH2) = M(BaH2)
/ (M(BaH2) + M(Li3N)) = 139 / (139+35) = 0.80 = 80%.
Ответ. 80%.
14. CO + Cl2 = COCl2
Концентрация фосгена через 5 минут после начала
реакции: c(COCl2) = 5 2.5 2.5 10–3
= 1.25 10–3
= 1.25 10–2 моль/л. Парциальное
давление фосгена: p = cRT = 1.25 10–2 моль/л. Парциальное
давление фосгена: p = cRT = 1.25 10–2 10–2 8.314
8.314 398 = 41.4 кПа. Общее давление через 5
минут складывается из давления фосгена и
давлений CO и Cl2, которые равны друг другу,
так как в исходной смеси n(CO) = n(Cl2). 398 = 41.4 кПа. Общее давление через 5
минут складывается из давления фосгена и
давлений CO и Cl2, которые равны друг другу,
так как в исходной смеси n(CO) = n(Cl2).
p = p(COCl2) + p(CO)
+ p(Cl2) = p(COCl2) + 2p(Cl2).
p(Cl2) = (p – p(COCl2))
/ 2 = (230 – 41.4) / 2 = 94.3 кПа.
В процессе реакции количество
прореагировавшего хлора равно количеству
образовавшегося фосгена:
nпрореаг(Cl2)
= nобр(COCl2)
поэтому уменьшение давления хлора равно
давлению фосгена:
p0(Cl2) –
p(Cl2) = p(COCl2),
p0(Cl2) = p(Cl2)
+ p(COCl2) = 94.3 + 41.4 = 135.7 кПа.
Ответ. 135.7 кПа.
15. Уравнения электролиза:
| Bi3+ + 3e®Bi |
4 |
| 2H2O – 4e®
O2 + 4H+ |
3 |
4Bi(NO3)3 + 6H2O
= 4Bi? + 3O2 + 12HNO3 |
| |
|
| Hg2+ + 2e®
Hg |
2 |
| 2H2O – 4e®
O2 + 4H+ |
1 |
2Hg(NO3)2 + 2H2O
= 2Hg? + O2 + 4HNO3 |
Пусть n(Bi(NO3)3) = x
моль, а n(Hg(NO3)2) = y моль.
Тогда n(Bi) = x моль, а n(Hg)
= y моль. Из условия задачи следует:
209x + 201y = 7.195.
Количество электронов, прошедших через
раствор: n(e) = It / F = 0.90 161 161 60
/ 96500 = 0.09 моль. Из уравнений восстановления ионов
металла следует: 60
/ 96500 = 0.09 моль. Из уравнений восстановления ионов
металла следует:
3x + 2y = 0.09.
Решая систему двух уравнений, находим: x = 0.02,
y = 0.015. Молярные концентрации солей:
с(Bi(NO3)3) = 0.02 / 0.16 = 0.125 M, с(Hg(NO3)2)
= 0.015 / 0.16 = 0.094 M.
Ответ. 0.125 М Bi(NO3)3,
0.094 М Hg(NO3)2.
16. Для реакции с диэфиром потребовалось 30 –
6 = 24 мл 1.00 М раствора NaOH, т.е. 0.024 моль. Уравнение
щелочного гидролиза:
ROOC-X-COOR + 2NaOH ® NaOOC-X-COONa + 2ROH
Количество диэфира n = 0.024/2 = 0.012
моль. Молярная масса диэфира: M(A) = 2.81 / 0.012 =
234.16 » 234 г/моль.
Судя по продуктам гидролиза, диэфир содержит
сложноэфирную группу COOCH3, другую
сложноэфирную группу COOR, содержащую бензольное
кольцо, и двойную связь CH=CH. С учетом оптической
активности спирта C, который образуется при
гидролизе, единственно возможная формула
диэфира A:
H3COCOCH=CHCOOCH(CH3)C6H5
(брутто-формула C13H14O4). При
гидролизе образуются CH3OH, дикарбоновая
кислота
HOOCCH=CHCOOH
и 1-фенилэтанол
C6H5CH(OH)CH3
(вещество C).
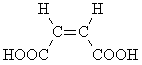
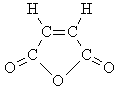
Непредельная кислота B при
дегидратации образует циклический ангидрид,
следовательно, вещество B – это цис-изомер:
Структурная формула D:
17. Запишем суммарное уравнение образования
смеси метана, этана и пропана в молярном
соотношении 3:2:2:
13CO + 33H2® 3CH4 + 2C2H6 + 2C3H8
+ 13H2O
Пусть в исходной смеси был 1 моль CO и 2 моль H2.
В реакцию вступил 0.1 моль CO. Количества газов в
смеси после реакции:
n(CO) = 1 – 0.1 = 0.9 моль,
n(H2) = 2 – 0.1?(33/13) = 1.75 моль,
n(CH4) = 0.1?(3/13) = 0.023 моль,
n(C2H6) = n(C3H8) = 0.1?(2/13)
= 0.015 моль,
n(H2O) = nпрореаг(CO)
= 0.1 моль.
До реакции в смеси было 3 моль газов, после
реакции – (0.9 + 1.75 + 0.023 + 2?0.015 + 0.1) = 2.80
моль. Общее давление уменьшилось в 3/2.8 = 1.07 раза.
Ответ. Уменьшилось в
1.07 раза.
18. Предположим для простоты, что
аминокислоты, образующие дипептид, содержат
только по одной аминогруппе. При кислотном
гидролизе дипептида образуются хлороводородные
соли аминокислот:
дипептид + 2HCl + H2O®ClH3NCH(R)COOH + ClH3NCH(R’)COOH
По массовой доле хлора можно найти молярную
массу одной из этих солей:
M(ClH3NCH(R)COOH) = 35.5 / 0.2829 = 125.5 г/моль, откуда M(R)
= 15 г/моль, R = CH3. Одна из аминокислот –
аланин.
С разбавленной соляной кислотой
пептид образует соль: дипептид + HCl®
дипептид HCl HCl
Молярную массу соли также находим по
содержанию хлора:
M(дипептид HCl) = 35.5 / 0.1671 = 212.5 г/моль,
откуда M(дипептида) = 176 г/моль. Дипептид
состоит из остатков двух аминокислот, одна из
которых – аланин (M = 89 г/моль): HCl) = 35.5 / 0.1671 = 212.5 г/моль,
откуда M(дипептида) = 176 г/моль. Дипептид
состоит из остатков двух аминокислот, одна из
которых – аланин (M = 89 г/моль):
аланин + аминокислота
= дипептид + H2O,
M(аминокисл.) = 176 + 18 – 89 = 105 г/моль. Такую
молярную массу имеет серин (R’ = CH2OH).
Искомый дипептид – Ala-Ser или Ser-Ala:

Ответ. Ala-Ser или Ser-Ala.
|