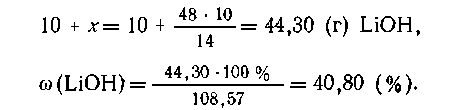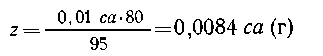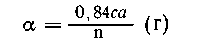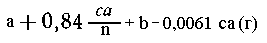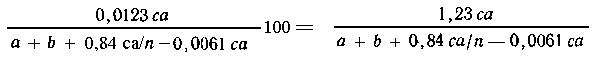Сорокин В.В.,
Загорский В.В., Свитанько И.В.Задачи химических
олимпиад.
2.2. УСЛОЖНЕННАЯ ПРОПОРЦИЯ
Массы реагирующих или образующихся химических
соединений на практике определить не всегда
просто. Так, исходные вещества задаются далеко не
всегда при нормальных условиях (т. е. 273 К и 1 атм),
они могут вводиться в виде растворов; продукты
реакции необходимо выделить количественно в
достаточно чистом виде для взвешивания или
определения объема. У аккуратно работающего
экспериментатора потери при выделении продукта
реакции составляют всего несколько процентов от
выхода, приведенного в методике. А неаккуратно
работать экспериментатору просто нельзя!
2.2.1. Количественные данные заданы в неявном
виде
Рассмотрим случай, когда исходные данные
задаются в неявном виде, т. е. перед
использованием этих данных для решения задачи и
подстановки их в основную пропорцию необходимо
провести дополнительные преобразования.
Напомним еще раз формулировку задачи, которая
представлена в начале второго параграфа.
При реакции вещества А с избытком вещества В
образуются вещества С и D. Относительные
молекулярные массы даны. Требуется определить
массу вещества С, если известно, что А находилось
в виде:
a.) m1 г раствора (или смеси)
с массовой долей компонента  (А) в %.
(А) в %.
Предварительно преобразуем массу вещества А к
явно заданному виду:
в 100 г раствора А
содержится  (А) г, (А) г, |
| в m1 г - " - -
" - ---"-----"-----"---m(А) г, |
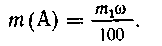
|
Запишем уравнение реакции:
аА + bВ = сС + dD, далее (см. 2.1) имеем
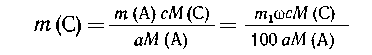
б.) V1(л) газа, измеренного при
давлении р1 и температуре Т1.
Приведем объем V(A) вещества А к явно заданному
виду (норм, условиям):
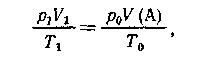 где po и Тo
- давление и температура при н. у. Отсюда
где po и Тo
- давление и температура при н. у. Отсюда 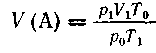 ;
;
затем составим пропорцию:
из а  22, 4 л А образуется с М(С) г
вещества С, 22, 4 л А образуется с М(С) г
вещества С, |
| из V(A) л ---"----"-----
"-----" m(С) г --- "-----"-" С, |
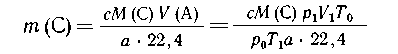 |
Пример 1. В запаянной колбе объемом 1 л,
содержащей воздух (давление 1000 Па при 0o С),
несколько суток прокаливали при 900o С 10 г
медных опилок. Какое давление будет в колбе после
охлаждения до 0oС? Что можно сказать о
составе газовой и твердой фаз, содержащихся в
колбе? Объемом твердых веществ пренебречь. Как
изменится решение, если вместо меди взять 10 г
магния?
Решение. Определяем исходные количества
вещества газов и металлов:
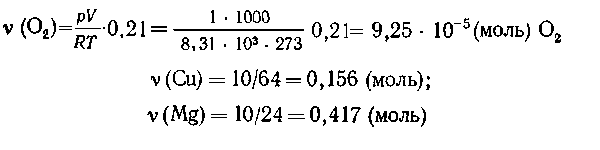
Все металлы взяты в избытке.
Реакции, происходящие при прокаливании:
| 4Cu + O2 = Cu2O; |
| 2Mg+O2 = 2MgO; |
| 3Mg + N2 = Mg3N2; |
| 2Mg+CO2 = 2MgO + C. |
Состав воздуха в процентах по объему: N2 -
78%; О2 - 21%; СО2 - 0,03%; благородные газы  0,93%.
0,93%.
При прокаливании меди состав содержимого
колбы: газы - СО2, N2, благородные газы;
твердые вещества - оксид меди(1) Сu2О;
давление в колбе -790 Па.
При прокаливании магния - благородные газы,
оксид магния MgO, нитрид магния Mg3N2,
сажа (С); давление в колбе 9,3 Па.
Пример 2. Какой станет массовая доля вещества
в растворе, если к 100 г раствора гидроксида лития
с массовой долей 10% добавить 10 г металлического
лития? Ответ подтвердите расчетами и уравнениями
реакций.
Общее указание ко всем задачам на определение
свойств смеси компонентов.
Массу смеси нужно определять сложением масс всех
компонентов независимо от происходящих реакций,
вычитая массу выделившегося газа или осадка,
если таковые образуются в результате реакции. Об
этом следует помнить всегда и когда при смешении
компонентов реакции не происходят, и когда
компоненты реагируют друг с другом. Решение.
Уравнение реакции:
10 г |
90 г |
|
х г |
y г |
| 2Li |
+2Н2O |
= |
2LiOH |
+ Н2. |
| Мг 14 |
|
|
48 |
2 |
В 100 г раствора содержится 10 (г) LiOH и 90 (г)
воды, при прибавлении 10 г лития выделится в виде
газа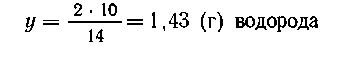 Масса раствора составит 110-1,43 = 108,57 г. В этом
растворе
Масса раствора составит 110-1,43 = 108,57 г. В этом
растворе
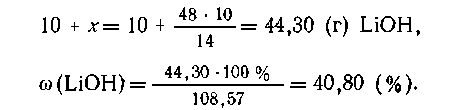
Пример 3. К а граммам с %-го
раствора хлорида магния прибавлено
эквивалентное (т. е. до окончания реакции, без
избытка) количество п %-го раствора
гидроксида натрия. Выпавший осадок отфильтрован
и промыт b миллилитрами воды.
Определить концентрацию хлорида натрия в
растворе, полученном смешением фильтрата и
промывных вод.
Решение. Уравнение реакции:
|
MgCl2 |
+ 2NaOH |
= |
Mg(OH)2 |
+ 2NaCl. |
| Мг |
95 |
2 40 40 |
|
58 |
2 58,5 58,5 |
Определим массу образовавшегося осадка:
| 95 г MgCl2 дают 58 г Mg(OH)2, |
| 0,01 са г MgCl2-- х г Mg(OH)2, |
х = 58/95 0,01с а = 0,0061 с а (г) Mg(OН)2. 0,01с а = 0,0061 с а (г) Mg(OН)2. |
Массу образовавшегося NaCl находим аналогично:
95 г - 2 58,5 г, 58,5 г, |
| 0,01 с а г - у г, |
| у = 0,0123 с а (г) NaCl. |
Определим массу раствора гидроксида натрия,
взятого для реакции:
| на 95 г MgCl2 требуется 80 г NaOH, |
| на 0,01 с а г ----"---"----" z
г NaOH, |
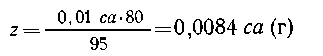 |
Масса взятого n %-го раствора NaOH составляет
| 0,0084 с а г - n%, |
| а
- 100%, |
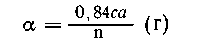 |
Тогда масса всего раствора после реакции и
промывки составит
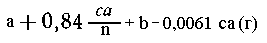
Массовая доля NaCl в растворе составит (%):
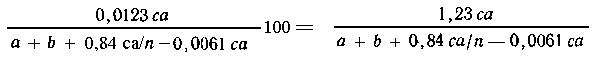
Пример 4. Жженые квасцы КАl(SО4)2
массой а г растворили в b мл воды. С каким
объемом с%-го раствора хлорида бария (плотность  )
может прореагировать m г раствора квасцов?
)
может прореагировать m г раствора квасцов?
Решение.
КАl(SО4)2 + 2ВаС12 = 2ВаSО4 + АlСl3
+ КСl.
+ АlСl3
+ КСl.
В m г раствора квасцов содержится 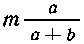 г, или
г, или 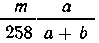 молей
квасцов. С таким количеством квасцов может
прореагировать
молей
квасцов. С таким количеством квасцов может
прореагировать 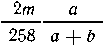 молей или
молей или 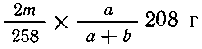 хлорида бария,
которые содержатся в
хлорида бария,
которые содержатся в 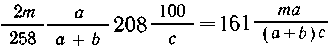 г с %-раствора,
или
г с %-раствора,
или 
Вариант косвенного задания массы: масса одного
из компонентов определяется в виде разности
между массой смеси двух веществ и массой второго
компонента.
Пример 5. Имеется 5 г смеси кальция и
оксида кальция. Какова масса кальция (г) в смеси,
если при реакции 1 г смеси с водой выделилось 224 мл
водорода (н. у.)? Какова масса (г) воды,
прореагировавшей с 1 г смеси?
Решение. Пусть в 1 г смеси было х г Са и (1-х)
г СаО.
| х г |
|
y г |
|
0,224 л |
| Са |
+ |
2H2 O |
= Са(ОН)2 + |
H2 ; ; |
| 40 г/моль |
|
2  18 г/моль 18 г/моль |
|
22,4 л/моль |
| X= 0,4 г Са, |
у = 0,36 г Н2О; |
|
|
|
0,6 г |
х г |
|
|
СаО + Н2О |
= Са(ОН)2; |
|
| Мг |
56 |
18 |
|
|
х =0,193 (г) Н20, |
|
Следовательно, в 5 г смеси содержится 2 г Са и 3 г
СаО, с 1 г смеси прореагировала вода массой 0,36 + 0,193
= 0,553 (г).
Пример 6. Эквимолярную смесь двух
галогенидов рубидия массой 4,51 г обработали
избытком нитрата серебра. При этом образовался
осадок массой 2,87 г. Определить, какие галогениды
присутствовали в смеси.
Решение. Так как масса осадка меньше
массы смеси, то осадок образует только один из
галоген-дов. Значит, одна из солей, не образующая
осадок, - фторид рубидия RbF (AgF растворим в воде).
Пусть RbF было а моль, его масса а (85,5+19) г,
тогда другого галогенида также было а моль и
его масса а (85,5 + д:) г, где х - молярная
масса галогенида X.
RbX + AgNO3 = AgX + RbNO3;
+ RbNO3;
| (x + 85,5) г галогенида образуют (108+ х)
г осадка, |
| а (х + 85,5) г - "---
"-----"----"-----" 2,87 г ----"---" , |
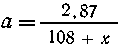
|
Масса смеси: а(85,5 + х) + а(85,5+19) = 4,51. Подставляя а,
находим x = 35,5. Значит, другая соль - хлорид
рубидия RbCl.

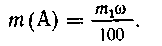
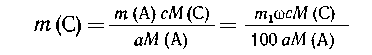
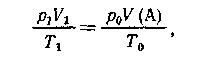 где po и Тo
- давление и температура при н. у. Отсюда
где po и Тo
- давление и температура при н. у. Отсюда 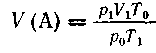 ;
;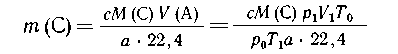
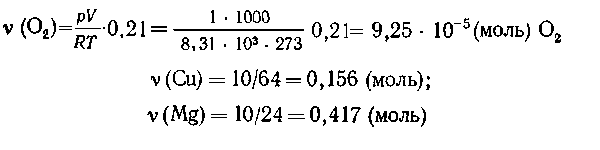
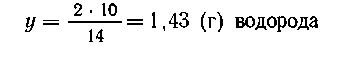 Масса раствора составит 110-1,43 = 108,57 г. В этом
растворе
Масса раствора составит 110-1,43 = 108,57 г. В этом
растворе