Примечание 1
1,3,5-циклогексатриен должен, например,
обесцвечивать бромную воду и раствор
перманганата калия; однако бензол не вступает в
эти реакции. Сравните химические свойства
бензола и циклогексена:

Примечание 2
Таким образом, С-С-связи в бензольном кольце
короче одинарных (1.54 А), но длиннее двойных
(1.32 А).
Примечание 3
Гидрирование алкенов сопровождается
выделением тепла, которое рассчитывают на 1 моль
субстрата и называют теплотой гидрирования.
Различие в теплотах гидрирования кратных связей
в различных соединениях позволяет оценить их
относительную устойчивость.
Примечание 4
О применимости правила Хюккеля к
полициклическим сопряженным системам см.раздел
III.3.
Примечание 5
При числе  -электронов
в плоской замкнутой
-электронов
в плоской замкнутой  -системе, равном (4n), молекула антиароматична;
это значит, что в этом случае делокализация
приводит к повышению энергии системы.
Примерами антиароматических молекул могут
служить циклобутадиен (n = 1), плоский
циклооктатетраен (n = 2), циклопропенилий-анион
и циклопентадиенилий-катион (n = 1).
-системе, равном (4n), молекула антиароматична;
это значит, что в этом случае делокализация
приводит к повышению энергии системы.
Примерами антиароматических молекул могут
служить циклобутадиен (n = 1), плоский
циклооктатетраен (n = 2), циклопропенилий-анион
и циклопентадиенилий-катион (n = 1).
Примечание 6
Впервые такой подход применительно к
циклическим полностью сопряженным полиенам был
сформулирован Э.Хюккелем в 1931 году и известен как
метод молекулярных орбиталей Хюккеля (МОХ).
Примечание 7
Круг Фроста позволяет также количественно
оценить уровни энергии МО циклических
сопряженных полиенов. Уровни энергии
циклических плоских сопряженных полиенов
задаются уравнением Еj=  +mj
+mj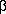 (Ej -
энергия j-го уровня, где
(Ej -
энергия j-го уровня, где  - кулоновский
интеграл,
- кулоновский
интеграл, 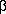 -
коэфициент, определяемый выражением mj=2cos(2j
-
коэфициент, определяемый выражением mj=2cos(2j /N) и называемый интеграл
перекрывания ). Если взять диаметр круга
Фроста равным 4
/N) и называемый интеграл
перекрывания ). Если взять диаметр круга
Фроста равным 4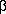 , то низшая
точка круга (самая низкая по энергии связывающая
, то низшая
точка круга (самая низкая по энергии связывающая  -МО) сответствует уровню
энергии, равному
-МО) сответствует уровню
энергии, равному  +2
+2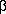 ; верхняя точка круга -
; верхняя точка круга -  -2
-2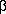 ;
энергии остальных орбиталей определяются из
геометрических соображений (для бензола,
например, они равны
;
энергии остальных орбиталей определяются из
геометрических соображений (для бензола,
например, они равны  +
+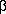 (две вырожденные
связывающие орбитали) и
(две вырожденные
связывающие орбитали) и  -
-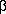 (две вырожденные
антисвязывающие орбитали)).
(две вырожденные
антисвязывающие орбитали)).
Примечание 8
Общая энергия шести  -электронов бензола по Хюккелю составляет 2(
-электронов бензола по Хюккелю составляет 2( +2
+2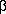 )+4(
)+4( +
+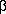 )=6
)=6 +8
+8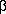 .
Для 1,3,5-циклогексатриена с локализованными
невзаимодействующими между собой двойными
связями общая энергия шести
.
Для 1,3,5-циклогексатриена с локализованными
невзаимодействующими между собой двойными
связями общая энергия шести  -электронов должна быть 6
-электронов должна быть 6 +6
+6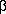 . Разность между этими двумя
величинами дает энергию стабилизации бензола
относительно гипотетического
"несопряженного" 1,3,5-циклогексатриена. Эта
энергия, по существу, отражает делокализацию
. Разность между этими двумя
величинами дает энергию стабилизации бензола
относительно гипотетического
"несопряженного" 1,3,5-циклогексатриена. Эта
энергия, по существу, отражает делокализацию  -электронов в бензоле, и
называется поэтому энергией делокализации.
В методе МОХ энергия делокализации для бензола
равна 2
-электронов в бензоле, и
называется поэтому энергией делокализации.
В методе МОХ энергия делокализации для бензола
равна 2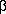 , где резонансный
интеграл
, где резонансный
интеграл 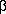 оценивается
примерно в 4 кДж/моль, т.е. энергия делокализации
бензола по Хюккелю равна ~ 8 кДж/моль. Эта величина
отражает особую устойчивость ароматического
секстета электронов.
оценивается
примерно в 4 кДж/моль, т.е. энергия делокализации
бензола по Хюккелю равна ~ 8 кДж/моль. Эта величина
отражает особую устойчивость ароматического
секстета электронов.
Примечание 9
Энергия  -электронов на
одной связывающей и двух несвязывающих
орбиталях равна 2(
-электронов на
одной связывающей и двух несвязывающих
орбиталях равна 2( +2
+2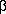 )+
)+ +
+ =4
=4 +4
+4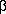 , т.е. такая же, как и для двух
независимых двойных связей - следовательно,
энергия делокализации нулевая.
, т.е. такая же, как и для двух
независимых двойных связей - следовательно,
энергия делокализации нулевая.
Примечание 10
Аннуленам соответствует формула CnHn.
Примечание 11
Другим способом преодоления препятствий,
связанных с отталкиванием атомов водорода у С(1) и
С(6), является формальное элиминирование
последних с образованием нафталина, также
обладающего ароматическими свойствами;
см.раздел III.3.
Примечание 12
Изображение строения нафталина, антрацена и
т.п. с помощью формул с кругом в центре может
привести к явному недоразумению, если каждый
круг принимать за изображение шести  -электронов; при такой форме записи
нафталин, например, должен иметь двенадцать, а не
реальных десять
-электронов; при такой форме записи
нафталин, например, должен иметь двенадцать, а не
реальных десять  -электронов. На самом деле, подобное написание
лишь отражает тот факт, что каждое кольцо носит
ароматический, а не непредельный или насыщенный
характер. Следует отметить, что ароматические
соединения являются тем классом веществ, где
химики испытывают наибольшие затруднения в
выражении структуры молекулы наиболее
адекватными структурными формулами.
-электронов. На самом деле, подобное написание
лишь отражает тот факт, что каждое кольцо носит
ароматический, а не непредельный или насыщенный
характер. Следует отметить, что ароматические
соединения являются тем классом веществ, где
химики испытывают наибольшие затруднения в
выражении структуры молекулы наиболее
адекватными структурными формулами.
Примечание 13
Для бифенилов, имеющих в орто-положениях
объемистые заместители, была обнаружена так
называемая атропо-изомерия (от греч. тропос
- поворот; атропос - нет поворота). Ее
существование связано с затрудненностью
свободного вращения вокруг С-С связи,
соединяющей ареновые кольца, в результате чего
молекула, например,
2,2'-динитро-6,6'-дикарбоксибифенила существует в
виде двух несовместимых в пространстве структур,
являющихся зеркальными отображениями друг друга
(т.е. оптических антиподов):

Примечание 14
Сходные структуры можно изобразить и для
делокализации положительного заряда в ди- и
триарилметильных катионах или неспаренного
электрона в ди- и триарилметильных радикалах.
Примечание 15
Следует иметь в виду, что рКа
сверхслабых кислот, как правило, представляют
собой оценочные значения; они могут сильно
варьировать в зависимости от метода оценки,
и, кроме того, сильно зависят от растворителя,
в котором оценивается константа кислотной
диссоциации. Особенно сильно влияет
растворитель на рКа cоединений,
способных образовывать водородные связи. Так, трет-бутанол
в ДМСО (апротонный растворитель) имеет рКа
31.3, а в воде (протонном растворителе) - рКа
19, то есть является в триллион раз более
сильной кислотой!
Примечание 16
Их получают обычно по одной из следующих
схем:

Примечание 17
Вследствие пространственных затруднений -
взаимодействия орто-водородов - фенильные
ядра в трифенилметильном радикале (катионе) не лежат
строго в одной плоскости, и он приобретает форму
пропеллера.
Примечание 18
Замена двух =СН-групп на два атома азота
приводит к азинам:
пиридазину, пиримидину и пиразину, а замена трех
=СН-групп - к триазинам:

Примечание 19
Введение второго гетероатома вместо группы
-СН=СН- приводит к потере ароматичности, но
дальнейшая замена одной или нескольких =СН-групп
"пиридиновыми" атомами азота =N- приводит к азолам
- пятичленным ароматическим соединениям,
содержащим два, три или четыре гетероатома:

Примечание 20
( Resonance Energy Per Electron). Этот параметр значительно
лучше согласуется с фактическими данными, чем
энергия делокализации по Хюккелю также в
пересчете на один электрон. Рассчитанная
величина REPE имеет наивысшее значение для бензола
и понижается при переходе к конденсированным
ароматическим соединениям; для циклобутадиена
она принимает отрицательное значение.
Примечание 21
В нафталине принята следующая нумерация
атомов углерода:

Примечание 22
Из одной тонны каменноугольной смолы
получается 8-10 кг бензола, 2 кг толуола, 0.3 кг
ксилола, 40-600 кг нафталина, 5-10 кг антрацена и т.д.
Всего в каменноугольной смоле идентифицировано
около 500 соединений, но предполагают, что общее их
число достигает десяти тысяч. Некоторые
ароматические углеводороды получают в
промышленности только таким путем.
Примечание 23
Наилучшие результаты получаются при
использовании арилбромидов и первичных
алкилбромидов. Данная реакция представляет
собой первый пример большой группы реакций кросс-сочетания
- реакций, в которых при взаимодействии
металлоорганических соединений с арил- и
алкилгалогенидами происходит сдваивание двух несимметричных
радикалов. Такого рода процессы, где в качестве
катализаторов используются комплексы
переходных металлов - палладия, никеля, циркония
и т.д., широко используются в современном
органическом синтезе.
Примечание 24
Так, например, получен и охарактеризован
комплекс бензола с бромом (1:1, т.пл. 14о С) и с
хлоридом алюминия (1:1).
Примечание 25
Удаление протона энергетически более
выгодно, чем присоединение нуклеофила (например,
противоиона от положительно заряженной частицы
Х+), так как в этом случае регенерируется
ароматическая система, что для бензола дает
выигрыш энергии в 150 кДж/моль.
Примечание 26
Подобная закономерность в соотношении
скоростей различных стадии реакции наблюдаются
не всегда. Так, например, скорость реакции
бромирования бензола бромом в присутствии FeBr3
в СН3СООН контролируется образованием  -комплекса. В этом случае
приведенная ниже энергетическая диаграмма
реакции в целом сохраняет свой вид, однако
изменяются относительные величины
энергетических максимумов.
-комплекса. В этом случае
приведенная ниже энергетическая диаграмма
реакции в целом сохраняет свой вид, однако
изменяются относительные величины
энергетических максимумов.
Примечание 27
При изменении скорость определяющей стадии
общий вид диаграммы изменения потенциальной
энергии сохранится; изменятся только
относительные величины Еа1, Еа2, Еа3
Примечание 28
Заместитель может, конечно, обнаруживать и
стерический эффект, однако действие этого
фактора имеет менее общий характер и
ограничивается, по существу, только атакой в орто-положение
(см. раздел IV.1.Д)
Примечание 29
Отметим, что в любой реакции замещения почти
всегда образуются некоторые количестве всех
трех изомеров (орто-, мета- и пара-), однако
количество мета-изомера при наличии орто-,
пара-ориентанта или орто- и пара-изомеров
при наличии мета-ориентанта обычно невелико.
Кроме того, не следует считать, что при
наличии активирующего заместителя только атомы
водорода в орто- и пара-положениях
подвергаются замещению быстрее, чем атомы
водорода в бензоле; мета-положение тоже
реагирует быстрее, чем бензол, но орто- и пара-положения
- быстрее, чем мета-. Аналогично, при наличии
дезактивирующих заместителей дезактивировано
и мета-положение, но оно дезактивировано в
меньшей степени, чем орто- или пара-.
Примечание 30
Мезомерный эффект обусловливает наличие
неподеленной пары р-электронов, а
индуктивный - различие в электроотрицательности
между углеродом и гетероатомом, несущим эту
электронную пару.
Примечание 31
При этом следует учитывать, что направление
замещения будет в основном определяться
влиянием более электронодонорного
заместителя.
Примечание 32
255 кДж/моль - энергия стабилизации нафталина;
150 кДж/моль - энергия стабилизации бензола; см.
раздел II.6.
Примечание 33
Иногда альтернативные продукты могут
взаимно превращаться путем прямой изомеризации,
без образования исходных веществ.
Примечание 34
Большая устойчивость 2-сульфкоислоты по
сравнению с 1-сульфокислотой объясняется тем, что
в 1-сульфокислоте имеет место дестабилизирующее
взаимодействие между объемистой группой SO3H
и атомом Н в соседнем положении (положении 8),
тогда как в 2-сульфокислоте атомы водорода в
положениях 1 и 3 более удалены от группы SO3H.
Примечание 35
Фтор очень агрессивен к углерод-углеродным
связям и разрушает ароматические соединения.
Примечание 36
Поляризация связи R-X, обусловленная
образованием комплекса с кислотой Льюиса,
возрастает от первичных к третичным
алкилгалогенидам, что связано с большей
устойчивостью вторичных и особенно третичных
карбокатионов по сравнению с первичными.
Реакционная способность уменьшается от
алкилфторидов к алкилиодидам, так как
образование комплекса с катализатором
затрудняется с ростом радиуса галогена. Наряду с
алкилгалогенидами для алкилирования часто
используют алкилтозилаты (R-O-SO2-Tol).
Примечание 37
Электрофильное ароматическое замещение при
действии алкилгалогенидов можно рассматривать
как нуклеофильное замещение в
алкилгалогенидах аренами, выступающими в роли
нуклеофилов.
Примечание 38
Если в белке отсутствуют ароматические
аминокислоты, окраска не появляется; например,
коллаген не содержит  -аминокислот, поэтому не дает
ксантопротеиновой пробы.
-аминокислот, поэтому не дает
ксантопротеиновой пробы.
Примечание 39
Примером может служить получение
пикриновой кислоты из симм-тринитробензола:

Реакцию проводят действием на тринитробензол
водного раствора Na2CO3 в присутствии
трикалийгексацианоферрата (для окисления
гидрид-иона); в отсутствие K3Fe(CN)6
реакция энергетически невыгодна и равновесие
смещается влево.
Примечание 40
В фенил-катионе, в отличие от бензил-катиона,
отсутствует возможность рассредоточения
положительного заряда.
Примечание 41
Такими веществами могут быть
тетрафенилгидразин, мета-динитробензол, ди-трет-бутилнитроксид
и др.; некоторые реакции ингибируются
молекулярным кислородом.
Примечание 42
Энергия связи С-Н в бензоле равна 460 кДж/моль,
что значительно превышает энергию вторичной С-Н
связи в алканах (400 кДж/моль). Поэтому уже первая
стадия гипотетического цепного радикального
замещения в бензоле оказывается эндотермичной,
что препятствует процессу замещения:
С6Н6 + Сl. 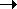 С6H5. + HCl +
С6H5. + HCl + 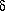 Ho;
Ho; 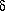 Ho = +
30 кДж/моль
Ho = +
30 кДж/моль
Примечание 43
Для этого соединения возможно
существование восьми пространственных изомеров;
все они образуются в данной реакции. Один из них
(гексахлоран или линдан) является инсектицидом. В
настоящее время гексахлоран снят с производства
в связи с его токсичностью для человека и
животных:

Примечание 44
Несопряженные циклические 1,4-диены очень
трудно получить в индивидуальном виде любым
другим способом.








![]() С6H5. + HCl +
С6H5. + HCl + ![]() Ho;
Ho; ![]() Ho = +
30 кДж/моль
Ho = +
30 кДж/моль