|
"Время в химии: кинетика и динамика"
Химическая термодинамика и химическая
кинетика - две стороны мироздания: первая
определяет его устойчивые состояния,
характеризует его стабильность и постоянство;
вторая символизирует его динамичность,
изменчивость.
Лекция 1. Химическая кинетика
Время в химию вводит химическая кинетика –
наука о скоростях химических процессов. Эта
наука универсальна, она пригодна для описания
всех химических реакций – от образования руд в
геохимических процессах с длительностью многих
миллионов лет до взрыва, происходящего за
миллионные доли секунды. Химическая кинетика
вошла во все разделы химии; она поднялась на
уровень общехимической науки, стала химической
культурой, составной частью химического
мышления.
Кинетические понятия и законы (порядок реакции,
закон действующих масс, уравнение Аррениуса)
преобразовались в кинетические признаки и
критерии механизмов химических реакций.
Фактически кинетика сформировала само это
фундаментальное понятие – химический механизм,
т.е. представление о том, в какой
последовательности и в каких комбинациях
реагируют молекулы, какие промежуточные частицы
(интермедиаты) реагирующая система создает на
своем пути от старта (реагенты) до финиша
(продукты).
Химическая кинетика установила принципиальные
механизмы огромного числа химических процессов
и объединила их в группы по принципу общности
кинетических признаков и механизма:
молекулярные, цепные, каталитические,
автокаталитические, радикальные, ионные и т.д. По
существу через химическую кинетику различные
типы реакций обрели свое характерное
индивидуальное "лица необщее выраженье" - от
горения водорода до металло-комплексного и
ферментативного катализа. Именно через кинетику
были открыты цепные реакции, проложившие прямые
пути в химические лазеры и в ядерную энергетику.
Считается, что химическая кинетика есть прямой
путь установления химического механизма
реакций. Однако для сложных реакций (например,
металлокомплексного катализа) этот путь
оказывается далеко не прямым и не однозначным.
Вообще возможно сосуществование различных
механизмов, различных интермедиатов, их взаимное
влияние, смена механизмов ("мерцающие"
механизмы). Разработаны новые сложные
компьютерные технологии и компьютерные
программы, которые в принципе способны сильно
уменьшить число возможных механизмов (или их
комбинаций), а затем сформулировать более
надёжно критерии и экспериментально измеряемые
параметры (например, изотопное замещение, эффект
растворителя, валентное состояние интермедиата
и т.д.) для того, чтобы выбрать наиболее реальные
механизмы (или их комбинацию), адекватные
наблюдаемой кинетике.
Скорость реакции, измеренная количеством
расходуемого реагента (или накопленного
продукта) в единицу времени (обычно в одну
секунду) зависит от концентрации реагента и
потому не является характеристикой реагентов.
Только константа скорости (т.е. скорость,
отнесенная к единичной концентрации каждого из
реагентов) является химической характеристикой
реагентов, количественным выражением их
реакционной способности; в свою очередь
реакционная способность является функцией
электронно-ядерной структуры молекул-реагентов.
Измеряя константу скорости, кинетика выступает
как химический "бухгалтер": она считает
число реагирующих молекул, т.е. число актов
реакции в единицу времени. Другими словами, она
считает количество химических событий,
происходящих за единичное время (например, за
одну секунду). Фактически кинетика измеряет
интервал времени между этими событиями, но
ничего не говорит о самом событии.
Лекция 2. Химическая реакция как
событие
Собственно химическая реакция, т.е.
преобразование молекул-реагентов в
молекулы-продукты, включает перегруппировку
атомов и преобразование их электронных
"одежд"; это центральное событие, вокруг
которого обращается вся химия, это сердце химии.
Это событие происходит на поверхности
потенциальной энергии реагирующей системы,
когда система движется из долины реагентов в
долину продуктов через перевал, высота которого
по отношению к уровню долины реагентов есть
энергия активации реакции, а конфигурация
(взаимное расположение) атомов реагирующей
системы на вершине перевала есть переходное
состояние реакции. Пример энергетической
поверхности показан на рис.1; перемещение из
долины реагентов в долину продуктов означает
перегруппировку атомов, составляющих
реагирующую систему.
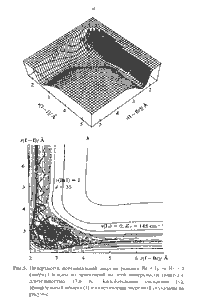
Времена этих перемещений и атомных
перегруппировок сравнимы с периодами колебаний
атомов в молекулах и составляют 10-12-10-11 с
(1-10 пикосекунд). Другими словами, длительность
собственно химического события составляет
величину порядка нескольких пикосекунд. (Так, на
рис.1 полная траектория преобразования реагентов
Br + I2 в продукты BrI + I длится 17.6 пс).
За последние пять лет в химию активно вторглись
новые, лазерные технологии исследования.
Разработана техника генерации и детектирования
ультракоротких лазерных импульсов с
длительностью 10-15-10-14 с (1-10
фемтосекунд); эти времена гораздо короче
периодов колебаний атомов в молекулах. Используя
такие короткие и повторяющиеся зондирующие
импульсы, можно осуществить почти непрерывный
мониторинг движения атомов реагирующей системы
на пути из долины реагентов в долину продуктов
(включая вершину перевала и его окрестности).
Наука, исследующая временнуе поведение
реагирующей системы на перевале и его
окрестностях, названа химической динамикой. В
отличие от химической кинетики, которая измеряет
время между химическими событиями, её наследник -
химическая динамика - измеряет время самого
события, следит за движением атомов в момент
преобразования реагентов в продукты. И если
химическая реакция - сердце всей химии, то
химическая динамика есть кардиограмма этого
сердца.
Лекция 3. От кинетики к динамике
Очевидно единство этих двух наук и их взаимная
дополнительность: кинетика отвечает на вопрос,
каков механизм реакции, в каких комбинациях
молекулы реагентов вступают в реакцию, какие
промежуточные частицы возникают на пути к
продуктам и в какой последовательности они
реагируют; динамика сообщает, как движутся атомы
на поверхности потенциальной энергии, как
осуществляется перегруппировка атомов в момент
рождения новых молекул из реагентов. Путь от
кинетики к динамике был непрост; он занял почти
все ушедшее столетие. Таблица показывает как
совершалась эволюция химической кинетики в
химическую динамику. Ведущим началом в этой
эволюции были экспериментальные методы
измерения скоростей реакций, их быстродействие.
Таблица. Химическая кинетика и
химическая динамика: иерархия времён
| |
 , сек , сек
|
Техника |
| КИНЕТИКА |
105 – 102
102 – 10-2
10-2 – 10-4
10-4 – 10-8
10-8 – 10-11 |
Контроль проб
Струя
Остановленная струя
Молекулярные пучки
лазерные технологии |
ДИНАМИКА |
10-12 – 10-15 |
Современные лазеры |
Сначала разрабатывались простые, наивные
методы (типа отбора и контроля проб); они годились
лишь для "неторопливых" реакций,
происходящих за часы или, в лучшем случае, за
минуты (105–102 с). Для быстрых
реакций (102–10-4 с) позднее были
созданы методы быстрого турбулентного смешения
потоков реагентов (в газе или в жидкости).
Дальнейшее продвижение в область быстрых
реакций (с временами 10-4 –10-11
с) связано с созданием новых технологий
химического эксперимента – молекулярные пучки и
импульсные лазерные технологии. Они породили
новую крупную область – экспериментальную
физику химических реакций, включающую методы
инфракрасной и оптической хемилюминесценции,
когерентного возбуждения,
лазерно-индуцированной флуоресценции,
время-пролетной масс-спектрометрии и
Допплер-эффекта, резонансно-усиленной
многофотонной ионизации, когерентного
рамановского рассеяния, спектроскопии нулевой
кинетической энергии, и др. Эти методы открыли
огромные возможности в приготовлении реагентов
в заданных состояниях с точной и контролируемой
энергией колебаний и вращений, с заданной
cкоростью и электронной энергией, с заданной
ориентацией и угловым моментом.
Был создан метод молекулярных потоков
(молекулярных пучков), когда каждый из реагентов
готовится в виде молекулярного пучка,
вылетающего из узкого отверстия; далее пучки
двух реагентов направляются друг на друга под
заданным углом (скрещенные молекулярные пучки) и
в столкновениях молекул- партнёров рождаются
молекулы-продукты. При этом реагенты готовятся в
заданном состоянии (с известной скоростью и
энергией вращения и колебания, с нужной
ориентацией, угловым моментом и электронной
энергией), а для молекул-продуктов,
образовавшихся при встречах реагентов в
скрещении молекулярных пучков, измеряется
скорость, энергия вращений и колебаний,
ориентация, угол рассеяния и др.). Фактически
методы скрещенных пучков дают полную
характеристику и реагентов, и продуктов.
Главное достоинство этих технологий даже не в
том, что они вплотную придвинулись к коротким
временам контакта реагентов, а в том, что они
"работают" с молекулами как с квантовыми
объектами, строго задавая квантовые состояния
реагентов и фиксируя квантовые состояния
продуктов. И все-таки даже эти блестящие,
элитарные технологии остаются кинетическими:
они говорят всё о реагентах и о продуктах, но
ничего не сообщают о главном событии - как
произошло преобразование реагентов в продукты;
это ещё не химическая динамика.
Лекция 4. Современная химическая
динамика
Рождение химической динамики из химической
кинетики происходит на "рубиконе" времени 10-12с.
Новое поколение лазеров внесло в химию новые
технологии коротких лазерно-оптических
импульсов длительностью 10-15-10-13с
(1-100 фемтосекунд). За это время атомы в
реагирующих молекулах перемещаются на
расстояние 0,1 – 0,01Е. Это означает, что мониторинг
движения атомов реагирующей системы на
поверхности потенциальной энергии (включая
вершину перевала и его окрестности)
осуществляется через каждые 0,1 – 0,01Е (т.е. с шагом
10-13 - 10-15с по времени и 0,1 – 0,01Е
по межатомному расстоянию). Ясно, что речь идет о
спектроскопии и химической динамике переходного
состояния; это динамика собственно химического
события – преобразования реагентов в продукты. И
это крупный прорыв в химии: то, что всегда было
предметом лишь теории, теперь стало объектом
экспериментального наблюдения и зондирования. И
этот блестящий прорыв стал крупным событием в
химии только что ушедшего века; его главным
вдохновителем стал американский физик Ахмед
Зевайл, увенчанный в 1999 г. Нобелевской премией.
Прорыв из химической кинетики в химическую
динамику создал также новую науку – когерентную
химию, которая "работает" с новой
коллективной частицей – волновым пакетом,
ансамблем абсолютно тождественных молекул с
синхронно (когерентно) колеблющимися атомами (с
одной частотой и фазой) и синхронно реагирующими,
так что когерентность реагентов наследуется в
продуктах. Такой ансамбль ведет себя как полк
солдат на параде – образ не слишком точен, но
нагляден.
Осуществляя мониторинг движения атомов на
потенциальной поверхности, можно также
вмешиваться в химическое поведение переходного
состояния, осуществляя его энергетическую
накачку или изменяя фазу. Это означает
управление переходным состоянием, его
химической судьбой, каналами его химического
превращения. Фактически это новая наука – химия
переходного состояния. Она получила название
фемтохимия, так как "разыгрывается" на
временах, измеряемых фемтосекундами (напомним: 1
фс = 10-15 с). И фемтохимия, и когерентная
химия – прекрасные черты нового лица химии
будущего века. Они имеют дело с движением атомов -
и хаотическим, и когерентным – в моменты главных
химических событий, когда реагенты
преобразуются в продукты. События эти
разыгрываются на химической сцене за времена 10-12
- 10-15 с.
Зевайл разработал также блестящую
экспериментальную технику прямого наблюдения за
перемещениями атомов в переходном состоянии, т.е.
в те моменты, когда из реагентов рождаются
продукты. В этой технике переходное состояние
зондируется пбрами фемтосекундных лазерных
импульсов. Первый импульс направляется на катод
и генерирует фотоэмиссию пучка электронов,
которые ускоряются сильным электрическим полем.
Второй фемтосекундный импульс направляется на
молекулярный пучок; он генерирует волновой пакет
или переходное состояние исследуемой реакции.
Далее происходит дифракция ускоренных
электронов, созданных первым импульсом, на
атомах переходного состояния и по рассеянию
электронов восстанавливается геометрия
переходного состояния (межатомные расстояния и
углы). Изменяя интервал времени между первым и
вторым импульсом, можно зондировать геометрию
переходного состояния в любой момент на пути
реагирующей системы из долины реагентов в долину
продуктов. Таким образом, современные методы
химической динамики зондируют перемещения
атомов в момент реакции в масштабе времени 10-15с,
причём детектируются и энергетические, и
пространственные параметры переходного
состояния.
Можно ли следить за движением электронов в
моменты химических преобразований, т.е.
наблюдать динамику электронов? Скорости
движения электронов на три порядка выше
скоростей движения атомов, поэтому для
мониторинга движения электронов нужны лазерные
зондирующие импульсы с длительностью 10-17
– 10-18 с. Имея такие импульсы, можно
готовить когерентные волновые пакеты электронов
(ансамбли молекул с осциллирующими электронными
потоками), наблюдать и контролировать движение
электронов в Н2 от одного атома к
другому, циркуляцию электронов в бензольном
кольце и т.д. И как в колебательных волновых
пакетах атомы принуждаются двигаться синхронно,
когерентно, так и в электронных волновых пакетах
движение электронов синхронизовано и
упорядочено. Хаос в движении заменяется строгим
управляемым порядком.
Физики сейчас активно работают над созданием
нового поколения лазеров, способных
генерировать такие ультракороткие импульсы,
которые способны когерентизировать движение
электронов в молекулах. Есть надежды на их успех
и с этим успехом ожидается крупный прорыв к новым
горизонтам химии.
Лекция 5. Фемтохимия
По образному определению Ахмеда Зевайла,
фемтохимия – "новая земля" в химии. Мы
обсуждали эту науку в связи с когерентной химией,
с физикой химических реакций; не будем
повторяться, лишь кратко суммируем, что принесла
в химию эта "новая земля".
Во-первых, времена 10 – 100 фс настолько малы
по отношению к периоду колебаний ядер, что за это
время ядра почти неподвижны и сохраняют свои
положения. Фемтосекундный импульс
"схватывает" ансамбли молекул с
определённым межатомным расстоянием и фазой
движений и "переносит" их в новый потенциал
почти мгновенно. В этом новом потенциале атомы
начинают новое, теперь уже когерентное,
синхронное движение. Фемтохимия привела в химию
новые частицы и новое состояние молекул – волновые
пакеты, а вместе с ними – когерентную химию.
Во-вторых, разрешение по времени 10-15 - 10-13с
(1 - 100 фс) соответствует разрешению по координате
0,1 - 0,01 Е; это означает, что именно с таким
координатным разрешением осуществляется
спектроскопический мониторинг движения ядер на
потенциальной поверхности, в том числе на
вершине барьера и в его окрестности. Фемтохимия
вводит в химию экспериментальную химическую
динамику в реальном времени - в отличие от
классической, "виртуальной" динамики,
которая не наблюдает реакцию как химическое
событие, а требует воображения, домысливания или
расчёта картины движения атомов в переходном
состоянии.
В-третьих, фемтохимия открыла возможность не
только спектроскопического мониторинга
переходного состояния, но и его геометрического,
пространственного мониторинга (см. предыдущий
раздел). Дифракция электронов на переходном
состоянии фактически даёт полную картину
пространственного и временного движения атомов
в момент реакции. Это высшее интеллектуальное
достижение химии, поражающее воображение своей
кажущейся невозможностью.
В-четвёртых, осуществляя мониторинг движения
ядер по потенциальной поверхности, можно
вмешиваться в динамику переходного состояния,
производя его энергетическую или фазовую
накачку, изменяя направления реакции уже самого
переходного состояния; можно сказать, что
фемтохимия есть химия переходного состояния.
Ярким примером управления переходным
состоянием является распад молекулы диоксида
хлора OClO: при энергиях накачки до ~0,3.1012 Вт/см2
распад идёт преимущественно по каналу O + ClO,
при энергии > 0,8 Вт/см2 второй канал - O2
+ Cl начинает преобладать и при 1,4.1012 Вт/см2
он превосходит первый канал в 12 раз. Самое
замечательное в том, что переключить полностью
реакцию с первого канала на второй можно
химическим способом, присоединив к диоксиду
хлора молекулу воды или поместив его в водный
кластер (H2O)n. Хотя в этом
случае результат такой же, как и в фемтохимии, но
он не имеет ничего общего с управлением
переходным состоянием; здесь изменилось
стартовое состояние реагентов, и реакция
двинулась по новой потенциальной поверхности -
классический случай изменения реакционной
способности путём комплексообразования или
сольватации.
И, наконец, в-пятых, фемтохимия предоставляет
огромные возможности и широкие кинетические
применения для исследования сверхбыстрых
реакций: перенос протона (электрона) в парах
кислота - основание (донор - акцептор);
таутомеризация; цис-транс изомеризация с
детектированием твист-конформации;
фотогенерация и релаксация пары электрон - дырка
в полупроводниках; элементарные стадии
фотосинтеза; распад молекул (например, иода в
кластерах, в областях фазового перехода газ -
жидкость и в сверхкритических условиях) и т.д.
Фемтохимия сообщает важные новости о
гетерогенных процессах, в частности, о десорбции
молекул и её механизме. Фемтосекундный импульс,
нагревая электронный газ до температуры
несколько тысяч градусов, оставляет фононы в
металле почти холодными (температура лишь
несколько сот градусов). Низкая фононная
температура не может быть причиной ни высоких
скоростей десорбции двухатомных молекул, ни их
высокой колебательной температуры (около 2000 К).
Ясно, что быструю десорбцию молекул (не более 10
колебаний на поверхности после фемтосекундного
импульса) стимулирует горячий электронный газ
(по-видимому, через рождение пары электрон - дырка
и её быстрой аннигиляции в месте адсорбции).
Независимые эксперименты с генерацией
поверхностной электромагнитной волны,
зондирующей поверхность и её адсорбционное
заполнение, подтвердили, что адсорбированная
молекула после запуска фемтосекундного импульса
живёт на поверхности лишь 3 - 5 колебаний.
Возможности фемтохимии приближаются к
детектированию таких быстрых электронных
событий как обмен электрона между протонами в
молекуле Н2+ (около 2 фс), миграция  - электронов в структурах Кекуле
бензола, обращение электрона вокруг атома,
перенос электрона при возбуждении на верхние
орбитали и т.д. - электронов в структурах Кекуле
бензола, обращение электрона вокруг атома,
перенос электрона при возбуждении на верхние
орбитали и т.д.
И конечно, огромная востребованность
фемтохимии имеется в молекулярной биологии; уже
сейчас начинается бурное вторжение фемтохимии в
химию живого. Вслед за этим следует ожидать новых
прорывов и в той, и в другой науке.
|

