3.2.Работа 1. Сильные электролиты
3.2.1. Цель работы
Изучить поведение водных растворов сильных
электролитов и влияние ионной силы раствора на
их свойства.
3.2.2. Реактивы
0,1 М растворы HCl, NaOH; насыщенные растворы K2SO4
(Na2SO4); набор эталонных буферных
растворов (с рН 1,68, 4,01, 6,86, 9,18), набор индикаторов,
универсальный индикатор.
3.2.3. Оборудование
рН-метр, мерные колбы на 50 мл, пробирки, мерные
пипетки, стаканы на 50 –100 мл, капельные пипетки.
Порядок проведения эксперимента
Опыт 1. Измерение рН растворов соляной
кислоты
Ознакомьтесь с инструкцией по работе на
рН-метре. Проведите калибровку прибора
Приготовьте по 50 мл 0,01 и 0,001 М растворов HCl,
используя в качестве исходного 0,1 М раствор.
Для этого, с помощью мерной пипетки налейте в
мерную колбу необходимое количество 0,1 М
кислоты, добавьте дистиллированную воду до
половины объема колбы и перемешайте раствор.
Затем добавьте воды до 3/4 объема колбы, вновь
перемешайте. После этого доведите объем раствора
до метки и перемешайте его, закрыв колбу пробкой.
Исходный 0,1 М раствор HCl и приготовленные 0,01 и
0,001 М растворы налейте в стаканчики на 50-100 мл
примерно на 1/3 – 1/2 их объема. Измерьте рН
растворов с помощью рН-метра.
ВНИМАНИЕ! Глубина погружения измерительного
электрода в раствор должна быть не менее ~25 мм,
при этом электрод не должен касаться ни дна, ни
стенок стакана.
Результаты измерения рН 0,1; 0,01 и 0,001 М
растворов HCl занесите в таблицу 3.1.
Вопросы и задания:
- Как согласуются между собой
экспериментальные значения рН 0,1, 0,01 и 0,001 М
растворов с теоретическими значениями для этих
растворов 1, 2, 3, соответственно?
- Можно ли утверждать, что разбавление раствора HCl
в 10 раз приводит к изменению рН на 1?
Опыт 2. Измерение рН растворов
гидроксида натрия
Приготовьте по 50 мл 0,01 и 0,001 М растворов
NaOH по методике, описанной в опыте 1. В качестве
исходного используйте 0,1 М раствор NaOH.
Проведите измерение рН исходного и
приготовленных растворов с помощью рН-метра.
Результаты опыта занесите в таблицу 3.1.
Таблица 3.1.
РН |
Концентрация
раствора HCl, моль/л |
Концентрация
раствора NaOH, моль/л |
0,1 |
0,01 |
0,001 |
0,1 |
0,01 |
0,001 |
| рН эксп.. |
|
|
|
|
|
|
| рН теор. |
|
|
|
|
|
|
Вопросы и задания:
- Как согласуются между собой
экспериментальные значения рН 0,1; 0,01 и 0,001 М
растворов с теоретическими значениями для этих
растворов 13, 12 и 11 соответственно?
- Можно ли утверждать, что разбавление раствора
NaOH в 10 раз приводит к изменению рН на 1 ?
Опыт 3. Влияние ионной силы раствора
на рН соляной кислоты
Налейте в стаканчик 30 мл 0,01 М раствора HCl,
измерьте рН этого раствора с помощью рН-метра.
Затем, добавляя по каплям насыщенный раствор Na2SO4
или K2SO4, добейтесь заметного
изменения рН раствора (не менее, чем на 0,05).
Заметьте объем прибавленного раствора.
Результаты измерений занесите в таблицу 3.2.
Таблица 3.2.
Раствор HCl
|
Объем |
|
| Концентрация ионов H+ |
|
| рН раствора |
|
Объем
насыщенного раствора соли |
в каплях |
|
| в мл |
|
| Общий объем раствора |
|
| Концентрация ионов H+ после
добавления соли |
|
| Рассчитанный рН раствора
после добавления соли |
|
| Экспериментальное
значение рН |
|
| Ионная сила раствора, 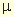 |
до добавления соли |
|
| после добавления соли |
|
Вопросы и задания:
- Почему при прибавлении насыщенного раствора
соли Na2SO4 или K2SO4 к 0,01 М
раствору HCl происходит изменение рН?
- Рассчитайте концентрацию ионов H+ в
растворе после добавления насыщенного раствора
соли.
- Соответствует ли значение рН раствора после
добавления соли вычисленной концентрации ионов H+?
Если нет, объясните, почему.
2.2.5.Что должен представить студент
преподавателю для сдачи работы
1. Таблицу 3.1 и 3.2 с результатами измерений рН и
расчетами.
2. Ответы на вопросы к опытам 1–4.