Глава 4. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
4.1 Теоретическая часть
Окислительно-восстановительные реакции (ОВР) – это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов.
Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
Окисление Окислитель |
Восстановление Восстановитель |
| Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем | |
Окислителями являются вещества, содержащие элемент, который может приобретать более низкую степень окисления, чем в данном веществе. Например, Fe+3 является окислителем в составе FeCl3, так как существует Fe+2 в составе FeCl2.
Восстановителями являются вещества, содержащие элемент, который может проявлять более высокую степень окисления. Например, Fe+2 в составе FeCl2 является восстановителем, так как существует Fe+3 в составе FeCl3.
В промежуточной степени окисления элемент может выступать как в роли окислителя, так и восстановителя. Например, сера (IV) в составе SO2 – окислитель, так как существует сера S (0) в простом веществе, и, в других обстоятельствах – окислитель, так как существует S (VI) в составе SO3.
Для составления уравнений окислительно-восстановительных реакций используют два метода подбора коэффициентов: электронного баланса и электронно-ионного баланса.
Для реакций, протекающих в водном растворе, предпочтителен метод электронно-ионного баланса. Этим методом составляются уравнения реакций окисления и восстановления реально существующих в растворе ионов (например, MnO42–, SO42–, Cr2O72–) и молекул (например, H2S, SO2, H2O2).
Молекулы растворителя (вода) или ионы среды (H+, OH–) также могут участвовать в процессе окисления-восстановления.
Среда должна учитываться при составлении уравнений ОВР в соответствии со следующими правилами:
Окислительную способность веществ характеризует окислительно-восстановительный потенциал E. В справочниках приведены стандартные окислительно-восстановительные потенциалы Eo, измеренные относительно обратимого водородного электрода.
В любой окислительно-восстановительной реакции как в исходных веществах, так и в продуктах реакции, имеются сопряженные пары окислитель-восстановитель. Направление окислительно-восстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше.
Например, в смеси веществ: K2Cr2O7, HCl, CrCl3, Cl2 (4.1) окислителями являются K2Cr2O7 и Cl2. Их стандартные окислительно-восстановительные потенциалы соответственно равны:.
Cr2O7 2– + 14H+ +6e = 2Cr 3+ + 7H2O Eo= +1,33 (4.2)
Cl2 +2e = 2Cl– Eo = +1,36 (4.3)
У хлора стандартный электродный потенциал выше, следовательно в стандартных условиях он является более сильным окислителем, чем дихромат калия. Соответственно в смеси веществ (4.1) при стандартных условиях должна идти реакция:
2CrCl3 + 3Cl2 + 7H2O = K2Cr2O7 + 14HCl (4.4)
Уравнения (4.2) и (4.3) называют уравнениями полуреакций.
Если разность стандартных восстановительных
потенциалов невелика ( не более ![]() 0.3В), направление
окислительно-восстановительной реакции можно
изменить, изменяя концентрации веществ и
температуру.
0.3В), направление
окислительно-восстановительной реакции можно
изменить, изменяя концентрации веществ и
температуру.
При изменении концентрации и температуры величина окислительно-восстановительного потенциала определяется уравнением Нернста
E=Eo + ![]() ln
ln![]() (4.5)
(4.5)
где R – газовая постоянная, 8,314 Дж/моль.К, Т – температура, К, n– число электронов, принимающих участие в полуреакции
Например, для полуреакции (4.2) для стандартной температуры 298К и с переходом от натурального логарифма к десятичному уравнение Нернста будет иметь вид
E=1,33 + (0,059/6) lg
Окислительно-восстановительные реакции
протекают самопроизвольно, если разность
стандартных электродных потенциалов окислителя
и восстановителя, или э.д.с.
окислительно-восстановительной реакции ![]() E > 0.
E > 0.
По известному значению ![]() Eo можно вычислить
Eo можно вычислить ![]() rGo и константу
равновесия К окислительно-восстановительной
реакции
rGo и константу
равновесия К окислительно-восстановительной
реакции
![]() rGo= –mF
rGo= –mF![]() Eo = –RTlnKp
Eo = –RTlnKp
где m – наименьшее общее кратное числа отданных и принятых в реакции электронов.
![]() E = (RT/mF) lnKр (4.7)
E = (RT/mF) lnKр (4.7)
На окислительную способность реагентов влияет pН среды.
Особенно наглядно это видно на примере окислительных свойств перманганат-иона.
Кислая среда
| MnO4– + 8H+ +5e | (бесцветный или слабо розовый) | |
| Eo = + 1,51 В | ||
| MnO4– + 4H+ +3e | |
(бурый раствор или осадок) |
| Eo = + 1,69 В |
Нейтральная среда
| MnO4– + 2H2O + 3e | ( бурый раствор или осадок) | |
| Eo = + 0,60 В |
Щелочная среда
| MnO4– + е | (зеленый раствор) | |
| Eo = + 0,56В |
Манганат ион MnO4 2– неустойчив и легко диспропорционирует
3MnO4 2– +2H2O + 2e ![]() 2MnO4– + MnO2 + 4OH–
2MnO4– + MnO2 + 4OH–
Для соединений хрома (VI) среда мало влияет на степень окисления продуктов, но вследствие амфотерности гидроксида хрома (III) оказывает влияние на их состав
Кислотная среда Cr2O7 2– + 6e + 14H+
![]() 2Cr 3++ 7H2O
2Cr 3++ 7H2O
Щелочная среда CrO4 2– + 3e +4H2O–
![]() Cr(OH)4– + 4OH–
Cr(OH)4– + 4OH–
Окислительные свойства галогенов ослабевают в ряду F2> Cl2> Br2> I2
| F2 + 2e = 2F– | Eo = + 2,87В |
| Cl2 + 2e=2Cl– | Eo= +1,36В |
| Br2+ 2e= 2Br– | Eo= + 1,06В |
| I2 +2e = 2I– | Eo= + 0,54В |
Наглядно это проявляется в реакции кристаллических солей галогенидов с концентрированной серной кислотой.
KCl + H2SO4 = KHSO4 + HCl
8KI + 9H2SO4 = 4I2 +H2S +4H2O+8KHSO4
В случае бромида идут обе реакции.
Убедиться в образовании галогенов можно по окраске бензольного слоя.
Пероксид водорода H2O2 проявляет как окислительные, так и восстановительные свойства. В зависимости от среды ОВР с его участием можно представить в виде следующих полуреакций
| Окислитель: | H2O2 +2H+ +2e = 2H2O | Еo=+1,77 |
| H2O2 +2e = 2OH– | Eo= 0,94 | |
| Восстановитель | H2O2 –2e = O2 + 2H+ | Eo=–0,68 |
| H2O2 + 2OH– –2e = O2 + 2H2O | Eo= +0,15 |
Например, пероксид водорода в щелочной среде окисляет Cr(III) до Cr(VI)
2[Cr(OH)4]– +3H2O2 +2OH– = 2CrO4 2– +8H2O и образуется желтый раствор хромата.
В сильно кислой среде под действием дихромата идет окисление пероксида водорода.
K2Cr2O7 + 4H2SO4 + 3H2O2 = 3O2 + Cr2(SO4)3 + K2SO4 +7H2O
В некоторых случаях, действие пероксида водорода на дихромат приводит к образованию различных пероксокомплексов, устойчивых только в органической фазе.
Например, в кислой среде образуются голубого цвета соединения состава
H2Cr2O7 + 4H2O2 =2CrO(O2)2H2O + 3H2O
Образующееся перекисное соединение экстрагируется в органический слой, окрашивая его в синий цвет. Эту реакцию используют в аналитической химии для обнаружения хрома (VI)
4.1.1.Вопросы по теме
4.2. Работа 1. Окислительно-восстановительные свойства веществ в различных степенях окисления
4.2.1. Цель работы
Исследование окислительных свойств соединений в высших, низших и промежуточных степенях окисления.
4.2.2. Реактивы
0,1 М KMnO4, 0,5 M K2Cr2O7, 1 M Na2SO3, 1 M NaOH, 1 M H2SO4, H2SO4 (d=1,83), бензол, свежеприготовленные растворы хлорной, бромной, иодной воды и 0,3 M Na2S, кристаллические KCl, KBr, KI.
4.2.3. Оборудование
Пробирки, штативы, шпатели
4.2.4. Порядок выполнения работы
Опыт 1. Окислительные свойства MnO4– в различных средах
Налейте в три пробирки по 2 капли 0,1 М раствора KMnO4 и по 1 мл дистиллированной воды, затем добавьте в первую пробирку 2 капли 1 М H2SO4, в третью 2 капли 1 M NaOH, потом добавьте во все пробирки по несколько кристаллов KI и по 1 мл бензола. Тщательно встряхните пробирки и дайте им постоять 2–3 минуты.
Внимание: После опыта растворы слейте в емкость "для слива".
Вопросы и задания
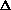 G, и
К реакций
G, и
К реакцийОпыт 2. Окислительные свойства Cr2O72– в различных средах
Налейте в две пробирки по 1 капле 0,5 М раствора дихромата калия и по 1 мл дистиллированной воды, затем добавьте в первую пробирку 2 капли концентрированной серной кислоты, а во вторую 2 капли 1 М NaOH. В каждую пробирку внесите на кончике шпателя несколько кристаллов KI или KBr, KCl ( по выбору преподавателя) и по 1 мл бензола. Тщательно встряхните обе пробирки и дайте им постоять 2–3 минуты.
Внимание: После опыта растворы слейте в емкость "для слива".
Вопросы и задания
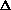 G, и
К реакций
G, и
К реакцийОпыт 3. Окислительные свойства галогенов
В три пробирки налейте по 2–3 капли свежеприготовленного раствора 0,3 М Na2S, затем добавьте в каждую пробирку по 2 капли 1 M H2SO4 . В первую пробирку прилейте 3 капли хлорной воды, во вторую прилейте 3 капли бромной воды, в третью – 3 капли иодной воды и тщательно перемешайте.
Внимание: После опыта растворы слейте в емкость "для слива".
Вопросы и задания
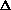 G, и
К реакций
G, и
К реакцийОпыт 4. Восстановительные свойства галогенид-ионов
(Опыт выполняется в вытяжном шкафу!)
В три пробирки осторожно налейте по 1 мл концентрированной серной кислоты. Затем в первую пробирку добавьте несколько кристаллов KCl, во вторую пробирку KBr, в третью KI. В каждую пробирку добавьте по 1мл бензола. Тщательно встряхните и дайте постоять 2–3 минуты.
Вопросы и задания
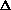 Gо,
и К реакций
Gо,
и К реакцийОпыт 5. Окислительно-восстановительные свойства сульфит-иона
Налейте в две пробирки по 2–3 капли 1 М раствора сульфита натрия. В первую пробирку добавьте 2 капли 1 M H2SO4 и 2 капли 0,5 M K2Cr2O7, во вторую пробирку 2 капли дистиллированной воды и 5 капель свежеприготовленного раствора Na2S . Тщательно перемешайте.
Вопросы и задания
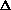 G, и
К реакций
G, и
К реакций4.2.5. Что должен студент представить преподавателю
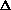 Gо, и К реакций
Gо, и К реакций4.3. Работа 2. Определение зависимости окислительно-восстановительного потенциала окислителя
от рН4.3.1. Цель работы
Выявить влияние величины рН на состав продуктов окислительно-восстановительной реакции
4.3.2.Реактивы
0,1 М KMnO4, 0,1 M H2SO4, 1 M H2SO4, 4–5 М H2SO4 ,H2SO4 k, 6M KOH, 1M KOH, 0,1 M KOH Na2SO3кр, 0,2–1M CrCl3, 2M NaOH, 10% (3%) H2O2, 0,1–0,5M K2Cr2O7, эфир (изоамиловый спирт)
4.3.3.Оборудование:
Пробирки, штативы, рН–метры, 8 мерных стаканов на 100 мл, пипетки, капельные, шпатели, горелка, пипетка на 1 мл, лучинка.
4.3.4 Порядок выполнения работы.
Опыт 6. Взаимодействие KMnO4 c Na2SO3 при различных рН
а) (Коллективный опыт) Приготовьте растворы перманганата калия с различными рН. Для этого возьмите 8 мерных стаканов, в каждый пипеткой внесите по 1 мл 0,1 М раствора перманганата калия.
Не забудьте смыть остатки раствора перманганата в пипетке в мерный стакан!
В первый добавьте 30–40 мл воды, внесите 3–4 капли концентрированной серной кислоты и добавьте воды до метки 50 мл. Измерьте рН с помощью рН–метра. (рН должен быть в интервале 1–2)
Во второй стакан добавьте 30–40 мл воды, внесите пипеткой 6–8 капель 0,1 М серной кислоты и добавьте воды до метки 50 мл. Измерьте рН ( рН должен быть в интервале 2–3)
В третий добавьте воды до метки 50 мл. Измерьте рН ( рН от 5 –8)
В четвертый стакан добавьте немного воды, внесите 2–4 капли 0,1 М КОН и добавьте воды до метки 50 мл. Измерьте рН( рН 9–10)
В пятый стакан внесите 7–10 капель 0,1 М КОН и добавьте воды до метки 50 мл. Измерьте рН ( рН 10–11)
В шестой стакан добавьте немного воды, 5–6
капель 6 М КОН и доведите водой до метки 50 мл.
Измерьте рН. ( рН ![]() 13)
13)
В седьмой стакан добавьте 10 мл 6 М КОН и
добавьте воды до 50 мл. Измерьте рН. (рН ![]() 13,5)
13,5)
В восьмой стакан добавьте 6 М KOH до 50 мл. Измерьте рН. Этот раствор необходимо готовить непосредственно перед проведением эксперимента
В случае, если измеренное значение рН оказывается больше рекомендуемого интервала( для кислой среды) или меньше (для щелочной) проведите коррекцию, добавив по 1–2 капли соответствующей кислоты или щелочи.
б) (Индивидуальный опыт) Отлейте полученные растворы в пробирки, предварительно пронумеровав их. Поместите пробирки в штатив. В каждую (кроме восьмой) внесите на шпателе несколько кристалликов сульфита натрия. Результаты наблюдений внесите в таблицу 4.2.
Таблица 4.2
N стакана |
рН |
Наблюдения |
|
| первоначальные | через 10–15 мин | ||
| 1 | |||
| 2 | |||
| 3 | |||
| 4 | |||
| 5 | |||
| 6 | |||
| 7 | |||
| 8 | |||
В графе "наблюдения" опишите прозрачность, цвет раствора, наличие осадка и его цвет.
В графе "наблюдения через 10–15 мин" опишите произошедшие изменения: изменение или усиление цвета, изменение прозрачности, появление или исчезновение осадка и его цвет и т.д.
Вопросы и задания
Опыт 7. Влияние концентрации и среды на реакцию пероксида водорода с соединениями хрома (III) и (VI)
7а) Взаимодействие хрома (III) с перокcидом водорода в щелочной среде
К 2–3 каплям раствора, содержащего соль хрома (III), добавьте по каплям 2 М NaOH до образования осадка Cr(OH)3 и далее до растворения последнего с образованием гидроксокомплексов. Затем добавьте 1–2 капли 10% Н2О2 ( или 6–8 капель 3% Н2О2) и нагрейте.
Вопросы и задания
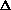 Gо
окислительно-восстановительной реакции.
Gо
окислительно-восстановительной реакции.7б) Реакция дихромата калия с пероксидом водорода в кислой среде
К 2–3 каплям раствора дихромата калия добавьте несколько капель 2 М серной кислоты. Затем добавьте или 6–8 капель 3% Н2О2.
Вопросы и задания
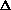 Gо и К
реакции
Gо и К
реакции7в) Качественная реакция на хром (VI)
К 2–3 каплям раствора дихромата калия добавьте 1 каплю 3% Н2О2, 3–4 капли эфира или изоамилового спирта и по каплям при встряхивании 4–5 М серную кислоту.
Вопросы и задания
7г) Каталитическое разложение пероксида водорода в присутствии дихромата калия
Приготовьте 0,02 М раствор дихромата калия из имеющегося в наличии раствора разбавлением. В пробирку налейте 2 мл пероксида водорода и добавьте 0,5 мл приготовленного раствора дихромата калия. Через 1–2 минуты внесите в пробирку тлеющую лучинку.
Оставьте раствор на 10–15 минут.
Качественно отметьте скорость выделения газа в
начале и конце опыта.
Вопросы и задания
4.3.5. Что студент должен представить преподавателю
4.4. Работа 3. Определение окислительно-восстановительной способности
(Проба на окислитель и проба на восстановитель)4.4.1.Цель работы
Определить, являются ли выданные Вам соединения окислителями или восстановителями.
4.4.2.Реактивы
0,1 М K2Cr2O7, 0,01 М KMnO4, раствор дифениламина в серной кислоте, 5% KI, раствор крахмала, H2SO4 (1:4), хлороформ или бензол. Растворы солей (0,1 M) по выбору преподавателя: Cr2(SO4)3 (или другая соль хрома (III)), 0,1 М MnSO4, 1 М FeCl3 (или 1 М Fe2(SO4)3), 1 М FeCl2 (или 1 М FeSO4 или соль Мора), NaNO2 (или KNO2), NaNO3 (или KNO3), KNO3, SnCl2, Na2SO4 (или K2SO4), Na2SO3 (или K2SO3).
4.4.3. Оборудование
Пробирки, (4–5) предметных стекол, стеклянная палочка (на каждого студента) капельные пипетки.
4.4.4. Порядок выполнения работы
Опыт 1. Проба на окислитель
| Проба на окислитель I: | На предметное стекло поместите отдельно 1–2 капли исследуемых растворов (KMnO4, FeCl3, NaNO3, K2SO4). Рядом наносят 1–2 капли раствора KI и 1–2 капли крахмала. Соедините капли исследуемого раствора, KI и крахмала стеклянной палочкой. Если раствор содержит окислители, наблюдают появление синей окраски. |
| Проба на окислитель II: "дифениламинная" | Дифениламин реагирует с окислителями с образованием дифенилбензидина, а затем синего хиноидного соединения: |

| Выполнение: 1 каплю исследуемого
раствора (KMnO4, FeCl3, NaNO3, K2SO4)
наносят на предметное стекло. Рядом наносят
каплю раствора дифениламина. Осторожно! Реактив
растворен в концентрированной серной кислоте!
Соединяют капли стеклянной палочкой. Если
исследуемый раствор содержит окислители,
появляется синее окрашивание. Опыт 2. Проба на восстановитель |
|
| Проба на восстановитель I: | Выполнение: На предметное стекло наносят отдельно по 2–3 капли исследуемого раствора (KNO2, FeCl2, K2SO3, SnCl2 или других по выбору преподавателя) рядом добавляют 1 каплю H2SO4 (1:4) и 1–2 капли раствора KMnO4. Соединяют растворы палочкой. Если раствор содержит восстановители, прибавляемый перманганат обесцвечивается. |
| Проба на восстановитель II: | Выполнение: 1–2 капли
исследуемого раствора (KNO2, FeCl2, K2SO3,
SnCl2 или других по выбору преподавателя)
наносят на предметное стекло и к ним добавляют 1
каплю H2SO4 (1:4). Рядом наносят 1–2 капли
раствора K2Cr2O7.Соединяют
стеклянной палочкой. Если раствор содержит
восстановители, желто-оранжевая окраска
бихромата переходит в зеленую окраску соли хрома
(III) Каким должен быть потенциал восстановителя для обнаружения этой реакцией? Какой окислитель, бихромат или перманганат, позволяет обнаруживать более слабые восстановители? . |
Заполните таблицу:4.4
Таблица 4.4.
Результаты проб |
Вывод |
||||
на окислитель |
на восстановитель |
||||
I |
II |
I |
II |
||
| вещество | |||||
Вопросы и задания
4.4.5.Что студент должен представить преподавателю
4.5. Задачи
Пользуясь табличными данными рассчитайте для
стандартных условий ![]() Ео,
Ео,
![]() rGо и константы
равновесия К этих реакций .
rGо и константы
равновесия К этих реакций .
Cr2O7 2– + 14H+ +6e = 2Cr 3+ + 7H2O