ВАРИАНТЫ С РЕШЕНИЯМИ
Вариант 19
1. Для некоторого газа получена зависимость
объема от температуры и давления: V = k1T + b, V = ![]() + b, где k1, k2 -
постоянные (соответственно при постоянных Р или
Т), b - индивидуальная константа газа. Допуская
существование функциональной связи между
объемом, давлением и температурой: V = f(T,Р) и
наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
+ b, где k1, k2 -
постоянные (соответственно при постоянных Р или
Т), b - индивидуальная константа газа. Допуская
существование функциональной связи между
объемом, давлением и температурой: V = f(T,Р) и
наличие полного дифференциала этой функции,
найдите уравнение состояния данного газа.
2. Покажите, что изотерма и адиабата идеального газа для равновесного процесса, проведенные на плоскости, могут пересекаться только в одной точке.
3. Напишите выражение для константы равновесия КP приведенной реакции: CrCl2 (тв) + H2 (г) U Cr (тв) + 2 HCl (г),
обозначив через х число молей прореагировавшего Н2, а через Р общее равновесное давление. В начальный момент исходные вещества взяты в стехиометрическом отношении, а продукты отсутствуют. Все газообразные соединения - идеальные газы.
4. Определите в общем виде изменение энергии
Гиббса ![]() G0268 при
кристаллизации 1 г переохлажденной до 268 К
воды, если известны удельные теплоемкости воды и
льда, а также удельная энтальпия кристаллизации
воды при 273 К. Какой знак и почему будет иметь
G0268 при
кристаллизации 1 г переохлажденной до 268 К
воды, если известны удельные теплоемкости воды и
льда, а также удельная энтальпия кристаллизации
воды при 273 К. Какой знак и почему будет иметь ![]() G0 в этом процессе?
G0 в этом процессе?
5. Почему при одинаковой концентрации
растворенного нелетучего вещества понижение
температуры плавления растворителя оказывается
большим по сравнению с увеличением температуры
его кипения: ![]() ТПЛ >
ТПЛ > ![]() ТКИП?
ТКИП?
6. Напишите реакции, протекающие на электродах в гальваническом элементе, схема которого приведена ниже, а также суммарное уравнение процесса.
Pt | H2 | HCl (водный р- р) | Cl2 (г) | Pt
Принимая во внимание связь ЭДС с изменением энергии Гиббса, определите, как изменится его ЭДС с увеличением внешнего давления.
7. Для некоторой необратимой химической
реакции получена температурная зависимость
времени превращения реагента на 25% от исходной
концентрации: ![]() 1/4 = f(T). Как
по этим данным можно определить энергию
активации реакции? Какие условия проведения
эксперимента необходимо соблюдать?
1/4 = f(T). Как
по этим данным можно определить энергию
активации реакции? Какие условия проведения
эксперимента необходимо соблюдать?
Решение варианта 19
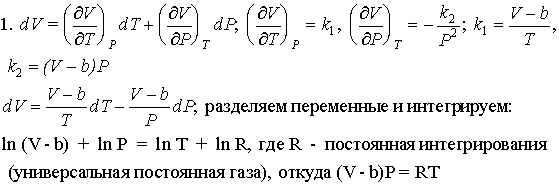
2. Изотерма идеального газа PV = const, адиабата
идеального газа PV![]() = const,
= const,
![]() = Cp/Cv > 1, поэтому
совпадение кривых возможно только в одной точке.
= Cp/Cv > 1, поэтому
совпадение кривых возможно только в одной точке.
3. CrCl2 (тв) + H2 (г) U Cr (тв) + 2 HCl (г)
число молей при равновесии: 1- x 2x
сумма молей S n = 1+x; KP = 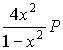
4. Расчет изменения энтальпии и энтропии проводим по равновесным стадиям нагрева переохлажденной воды до 273 К, кристаллизации и охлаждения льда до 268 К при условии постоянства теплоемкостей:
![]() Н0268 = СР,Ж
(273- 268) +
Н0268 = СР,Ж
(273- 268) + ![]() Н0273 + СР,ТВ
(268- 273) =
Н0273 + СР,ТВ
(268- 273) = ![]() Н0273 +
Н0273 +
+ (СР,Ж - СР,ТВ) ![]() Т
Т
![]() S0268 = CP,Ж
S0268 = CP,Ж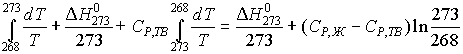
![]() G0268 =
G0268 = ![]() H0268 - 268?
H0268 - 268? ![]() S0268
S0268
5. 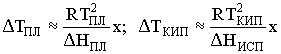 , где х - мольная
доля растворенного вещества.
, где х - мольная
доля растворенного вещества. ![]() НПЛ
НПЛ
![]()
![]() НИСП, что приводит к
НИСП, что приводит к ![]() ТПЛ >
ТПЛ > ![]() ТИСП,
несмотря на то, что ТКИП > ТПЛ.
ТИСП,
несмотря на то, что ТКИП > ТПЛ.
6. Н2 - 2е ![]() 2Н+
2Н+
Cl2 + 2е ![]() 2Cl-
2Cl-
H2 (г) + Cl2 (г) ![]() 2HCl
(водный р- р)
2HCl
(водный р- р)
![]() G = - nFE;
G = - nFE; 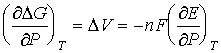 ;
; ![]() V < 0, ЭДС возрастает с
увеличением давления.
V < 0, ЭДС возрастает с
увеличением давления.
7. 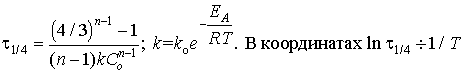 получаем прямую
линию, из тангенса угла наклона которой находим
энергию активации ЕА. Необходимые условия:
закрытая система, постоянство начальной
концентрации C0 и порядка реакции n при
разных температурах, независимость k0 от
температуры.
получаем прямую
линию, из тангенса угла наклона которой находим
энергию активации ЕА. Необходимые условия:
закрытая система, постоянство начальной
концентрации C0 и порядка реакции n при
разных температурах, независимость k0 от
температуры.