


Метаболизм. Энергетика
Синтез АТФ
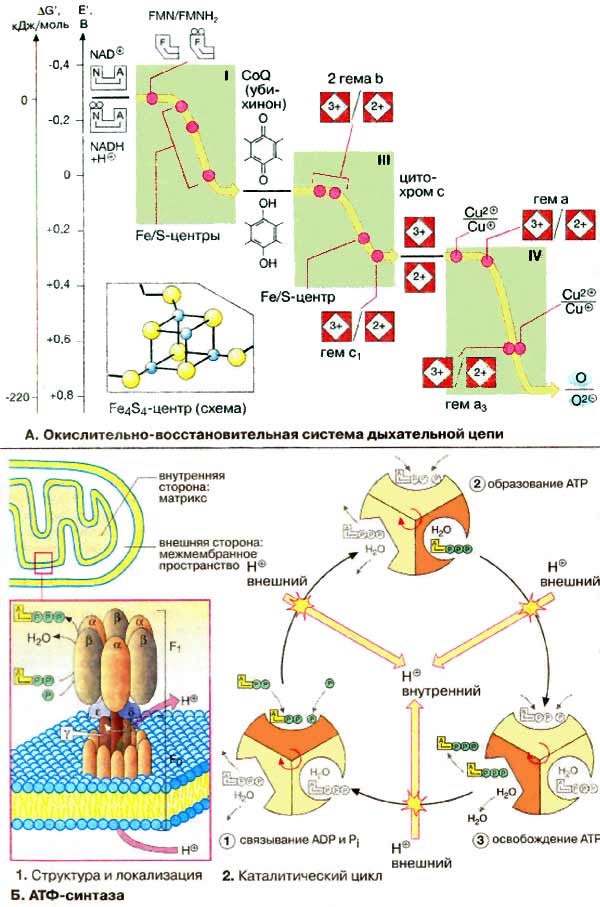 В дыхательной цепи электроны переносятся
от НАДН или убихинона (QH2) на О2. Выделяющаяся энергия
используется для создания протонного градиента на внутренней митохондриальной
мембране (см. с. 142). Синтез АТФ сопряжен с обратным потоком протонов из
межмембранного пространства в матрикс (см. с. 142).
В дыхательной цепи электроны переносятся
от НАДН или убихинона (QH2) на О2. Выделяющаяся энергия
используется для создания протонного градиента на внутренней митохондриальной
мембране (см. с. 142). Синтез АТФ сопряжен с обратным потоком протонов из
межмембранного пространства в матрикс (см. с. 142).
А. Окислительно-восстановительная
система дыхательной цепи
Электроны, передаваемые НАДН (NADH), не переносятся прямо на
кислород. Они проходят по меньшей мере десять промежуточных окислительно-восстановительных
систем, большинство из которых это связанные простетические группы в
комплексах I, III и IV. Прежде всего поражает большое число коферментов, принимающих
участие в переносе электронов. Как показано на с. 24, изменение
свободной энергии ΔG в реакциях восстановления зависит только от разности
окислительно-восстановительных потенциалов донора и акцептора. Наличие дополнительных
окислительно-восстановительных систем между НАДН и О2 не приводит
к изменению свободной энергии реакции. Общая величина энергии реакции (более
200 кДж/моль) разбивается на небольшие и более удобные «пакеты», величина
которых определяется разностью окислительно-восстановительных потенциалов соответствующих
промежуточных продуктов. Предполагается, что это разделение на пакеты обеспечивает
дыхательной цепи удивительно высокий выход энергии, составляющий примерно 60%.
На схеме представлены основные окислительно-восстановительные системы митохондриального
электронного транспорта и их приблизительные окислительно-восстановительные
потенциалы. Эти потенциалы важны для переноса электронов, так как для обеспечения
спонтанного переноса члены окислительно-восстановительного ряда должны
располагаться в порядке возрастания потенциалов (см. с. 38).
В комплексе I электроны переносятся от
НАДН на ФМН (FMN, см. с. 108), а затем на железосодержащие белки
(Fe/S-центры). Эти окислительно-восстановительные системы стабильны только в
составе молекул белков. Они могут содержать от 2 до 6 ионов железа, образующих
комплексы различного состава с неорганическим сульфидом и SH-группами остатков
цистеина. На схеме показана структура так называемого
Fe4S4-центра.
В переносе электронов принимают участие различные типы гемов.
Гемы типа b соответствуют гемоглобинам (см. рис. 277).
Гем с ковалентно связан с белком (см. с. 108),
в то время как тетрапиррольное кольцо гема а изопренилировано и несет
формильную группу. В комплексе IV непосредственно с кислородом взаимодействуют
ион меди (CuB) и гем а3. Свойства кофермента Q и цитохрома
с рассмотрены на с. 142.
Б. АТФ-синтаза
Н+-транслоцирующая
АТФ-синтаза состоит из двух частей: встроенного в мембрану протонного
канала (F0) из по меньшей мере 13 субъединиц и каталитической
субъединицы (F1), выступающей в матрикс. «Головка» каталитической
части образована тремя α- и тремя β-субъединицами, между которыми расположены
три активных центра. "Ствол" структуры образуют полипептиды F0-части
и γ-, δ- и ε-субъединиц головки.
Каталитический цикл подразделяется на
три фазы, каждая из которых проходит поочередно в трех активных центрах. Вначале
идет связывание АДФ (ADP) и Ρi (1), затем образуется фосфоангидридная
связь (2) и, наконец, освобождается конечный продукт реакции (3). При каждом
переносе протона через белковый канал F0 в матрикс все три активных
центра катализируют очередную стадию реакции. Предполагается, что энергия
протонного транспорта прежде всего расходуется на поворот γ-субъединицы, в
результате которого циклически изменяются конформации α- и
β-субъединиц.