


Метаболизм липидов
Биосинтез жирных кислот
 Биосинтез жирных кислот катализируется
синтазой жирных кислот. Эта ферментная система локализована в цитоплазме
и нуждается в качестве затравки в ацетил-КоА. В циклической реакции одна
молекула удлиняется семикратно на С2-звена. В качестве конечного
продукта реакции образуется анион С16-кислоты, пальмитат.
Фактический субстрат реакции удлинения цепи малонил-КоА на каждой стадии
конденсации отщепляет карбоксильную группу в вида СО2.
Восстановителем в синтезе жирных кислот является НАДФН + Н+. В
результате на синтез одной молекулы пальмитата расходуется одна молекула
ацетил-КоА, 7 молекул малонил-КоА и 14 молекул НАДФН + Н+; при этом
образуются 7 молекул СО2, 6 молекул H2O, 8 молекул КоА и
14 молекул НАДФ+.
Биосинтез жирных кислот катализируется
синтазой жирных кислот. Эта ферментная система локализована в цитоплазме
и нуждается в качестве затравки в ацетил-КоА. В циклической реакции одна
молекула удлиняется семикратно на С2-звена. В качестве конечного
продукта реакции образуется анион С16-кислоты, пальмитат.
Фактический субстрат реакции удлинения цепи малонил-КоА на каждой стадии
конденсации отщепляет карбоксильную группу в вида СО2.
Восстановителем в синтезе жирных кислот является НАДФН + Н+. В
результате на синтез одной молекулы пальмитата расходуется одна молекула
ацетил-КоА, 7 молекул малонил-КоА и 14 молекул НАДФН + Н+; при этом
образуются 7 молекул СО2, 6 молекул H2O, 8 молекул КоА и
14 молекул НАДФ+.
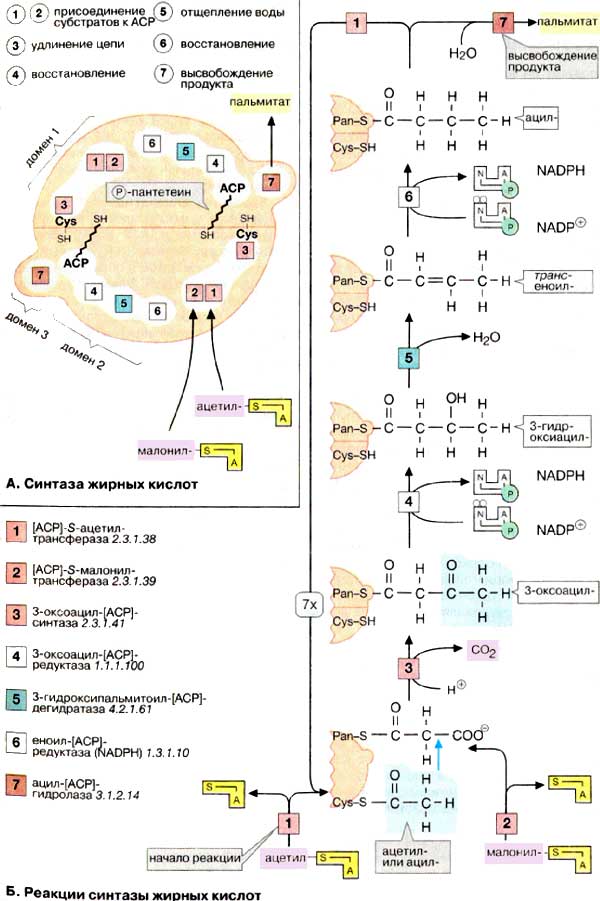
А. Синтаза жирных кислот
Синтаза жирных кислот позвоночных состоит из двух идентичных
пептидных цепей, т. е представляет собой гомодимер. Каждая из двух пептидных
цепей, представленных на рисунке в виде половинок шара, может катализировать
семь различных реакций ([1]-[7]),
из которых складывается синтез пальмитата. Пространственное объединение нескольких
последовательных реакций в таком мультиферментном комплексе имеет ряд принципиальных
преимуществ по сравнению с отдельными ферментами; предотвращаются конкурентные
реакции, последовательные реакции согласованы как на конвейере, реакции протекают
особенно эффективно благодаря высокой концентрации субстрата из-за незначительных
потерь за счет диффузии.
Каждая половинка синтазы жирных кислот
может связывать субстрат тиолсложноэфирной связью (ацильный или ацетильный
остаток) по двум SH-группам: цистеинового остатка (Cys-SH) и
4'-фосфопантетеиновой группы (Pan-SH). Pan-SH, очень похожий на кофермент
А (см. рис. 111), связан с доменом синтазы, который называют ацилпереносящим
белком [АПБ (ACP). Эта часть фермента функционирует как "длинная рука",
которая фиксирует субстрат и передает его от одного реакционного центра к
другому. Интересно отметить, что реакция при этом зависит от согласованности
действия обеих половинок синтазы. Поэтому фермент функционально активен только в
виде димера.
Активность мультиферментного комплекса
пространственно распределена по трем различным доменам. Домен 1
катализирует перенос субстратов ацетил-КоА и малонил-КоА
[АПБ]-S-ацетилтрансферазой [1] и [АПБ]-S-малонилтрансферазой [2] и
последующую конденсацию обоих партнеров 3-оксоацил-[АПБ]-синтазой [3],
домен 2 восстанавливает растущую цепь жирной кислоты с помощью
3-оксоацил-[АПБ]-редуктазы [4], 3-гидроксиацил-[АПБ]-дегидратазы
[5] и еноил-[АПБ]-редуктазы [6]. Наконец, домен 3 после семи
циклов удлинения цепи катализирует высвобождение готового продукта с помощью
ацил-[АПБ]-гидролазы [7].
Б. Реакции синтазы жирных кислот
Биосинтез пальмитата (на схеме внизу)
начинается с переноса ацетильной группы на уже упомянутый остаток цистеина
(Cys-SH) [1] и малонильной группы на 4-фосфопантетеин (Pan-SH) в АПБ [2].
Удлинение цепи происходит вследствие переноса ацетильной группы на углеродный
атом С-2 малонильного остатка (голубая стрелка), причем свободная карбоксильная
группа отщепляется в виде СО2 [3]. Следующие три стадии реакции, а
именно восстановление 3-оксогруппы [4], отщепление воды [5] и вновь
восстановление [6], приводят к жирной кислоте с четырьмя углеродными атомами.
Ацилтрансфераза [1] переносит этот промежуточный продукт на цистеиновый остаток,
освобождая Pan-SH для присоединения следующего малонильного остатка. После семи
циклов ацил-[АПБ]-гидролаза [7] «опознает» и освобождает конечный продукт
— молекулу пальмитиновой кислоты.