


Основы биохимии. Физическая химии
Энергетика
 Прежде чем рассматривать процессы, лежащие в
основе накопления и превращения энергии в живой клетке, представляется полезным
напомнить физико-химические основы этих процессов.
Прежде чем рассматривать процессы, лежащие в
основе накопления и превращения энергии в живой клетке, представляется полезным
напомнить физико-химические основы этих процессов.
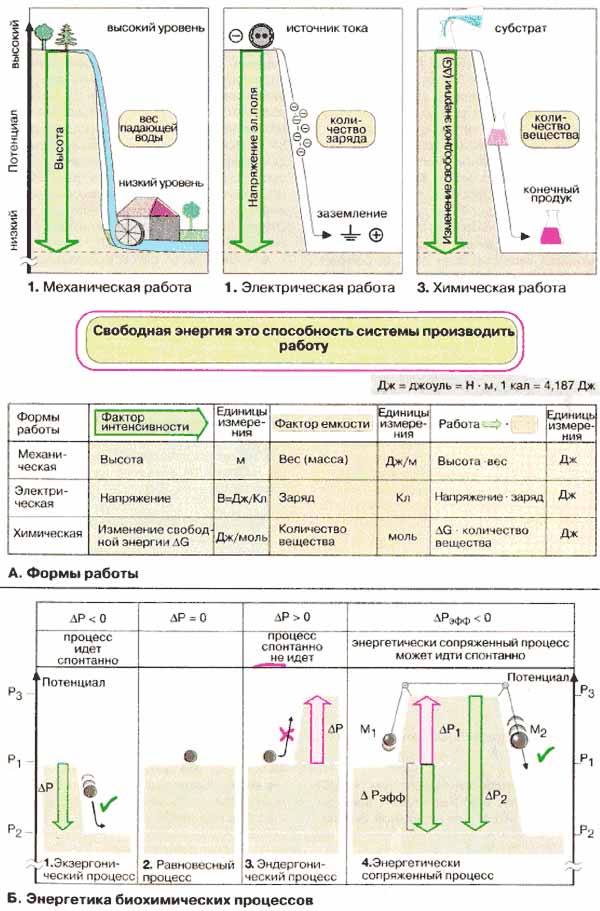
А. Формы работы
Различают следующие формы энергии;
механическую, электрическую, химическую и энергию излучения. При этом работа и
энергия — взаимосвязанные величины. Обе величины, энергия и работа, измеряются в
джоулях (1 Дж = 1 H · м). Устаревшая единица — калория (кал, 1 кал
= 4,187 Дж). Свободная энергия определяется как та часть энергии системы,
которая может производить работу.
Система в состоянии производить работу,
когда она переходит из начального состояния в конечное с уменьшением энергии
(химического потенциала). Это абстрактное положение наиболее наглядно
демонстрируется на примере совершения механической работы (1): благодаря силе
земного притяжения энергия предмета (потенциальная механическая энергия), в
данном случае энергия воды, тем выше, чем дальше этот предмет удален от центра
Земли. Перепад высот между высокой и низкой точками определяется как разность
потенциалов (ΔР). Поток воды самопроизвольно устремляется вниз, по
градиенту потенциала, и при этом совершает работу, например вращает колесо
водяной мельницы. Совершаемая работа может рассматриваться как функция двух
величин: фактора интенсивности или разности потенциалов, т. е. «движущей
силы» процесса (в приведенном примере высоты водопада), и фактора
емкости, т. е. массы вещества (в данном случае массы падающей воды). В
случае совершения электрической работы (2) фактор интенсивности — электрическое
напряжение, т. е. разность электрических потенциалов источника тока и «земли», а
фактор емкости — величина заряда.
Превращение энергии в биохимических реакциях
следует тем же закономерностям. Определенные вещества или группы веществ
обладают высоким химическим потенциалом. При биохимических реакциях образуются
конечные продукты с низким химическим потенциалом. Разность химических
потенциалов ("движущая сила» биохимической реакции) соответствует изменению
свободной энергии (ΔG). Фактором емкости в данном случае является
количество вещества (в молях).
Б. Энергетика биохимических процессов
Возможность спонтанного прохождения
какого-либо процесса зависит от того, какой знак будет иметь разность химических
потенциалов конечного и исходного состояния системы (ΔΡ = P2 -
Р1). Если P2 меньше Р1 и ΔΡ — величина
отрицательная, то процесс идет спонтанно и при этом производится работа. Такой
процесс носит название экзергонического (1). Если разность
потенциалов близка к нулю, то система находится в равновесии (2). В случае
эндергонического процесса ΔΡ — величина положительная (3), т. е.
процесс не может идти самопроизвольно.
Для того чтобы запустить эндергонический
процесс, необходимо воспользоваться принципом энергетического сопряжения.
Наиболее наглядно это можно продемонстрировать на примере механической работы
(4): когда две массы M1 и M2 связаны шнуром, M1
будет двигаться вверх несмотря на то, что этот процесс эндергонический, т. е. в
сопряженной системе определяющим фактором будет сумма разностей потенциалов двух
процессов (ΔРЭФФ = ΔP1 + ΔP2). Суммарный
процесс возможен при условии, если ΔРЭФФ — величина отрицательная.
Благодаря энергетическому сопряжению возможно взаимопревращение одних форм
работы и энергии в другие. Например, в батарейке карманного фонарика
экзергоническая химическая реакция генерирует электрическое поле, которое
используется для эндергонического процесса получения световой энергии. В мышцах
(см. с. 318) химическая Энергия трансформируется в механическую работу и
тепловую энергию.