


Рост и развитие. Деление клеток
Цитостатики
 Опухоль состоит из трансформированных
клеток, которые благодаря мутации растут бесконтрольно (см. с. 384). Большинство
трансформированных клеток распознаются и устраняются иммунной системой
(см. с. 286). Ослабление защитных сил организма влечет за собой быстрое развитие
опухоли. Можно пытаться подавить рост опухоли методами физио- или химиотерапии.
Для этих целей используют рентгеновское облучение, которое благодаря
мутагенному действию блокирует размножение клеток (см. с. 252). Еще большее
применение получило подавление опухолевого роста с помощью химиотерапии.
Применяющиеся для этих целей вещества носят название цитостатиков. К
сожалению, как облучение, так и химиотерапия — методы недостаточно
избирательные, т. е. при таком воздействии на организм повреждаются и нормальные
клетки, вследствие чего часто наблюдаются побочные эффекты.
Опухоль состоит из трансформированных
клеток, которые благодаря мутации растут бесконтрольно (см. с. 384). Большинство
трансформированных клеток распознаются и устраняются иммунной системой
(см. с. 286). Ослабление защитных сил организма влечет за собой быстрое развитие
опухоли. Можно пытаться подавить рост опухоли методами физио- или химиотерапии.
Для этих целей используют рентгеновское облучение, которое благодаря
мутагенному действию блокирует размножение клеток (см. с. 252). Еще большее
применение получило подавление опухолевого роста с помощью химиотерапии.
Применяющиеся для этих целей вещества носят название цитостатиков. К
сожалению, как облучение, так и химиотерапия — методы недостаточно
избирательные, т. е. при таком воздействии на организм повреждаются и нормальные
клетки, вследствие чего часто наблюдаются побочные эффекты.
Большинство цитостатиков прямо или косвенно подавляют удвоение
ДНК в S-фазе клеточного цикла (см. с. 380). Первая группа
веществ (A) взаимодействует с молекулами ДНК, блокируя
при этом процессы транскрипции и репликации. Вторая группа цитостатиков (Б)
подавляет синтез предшественников ДНК.
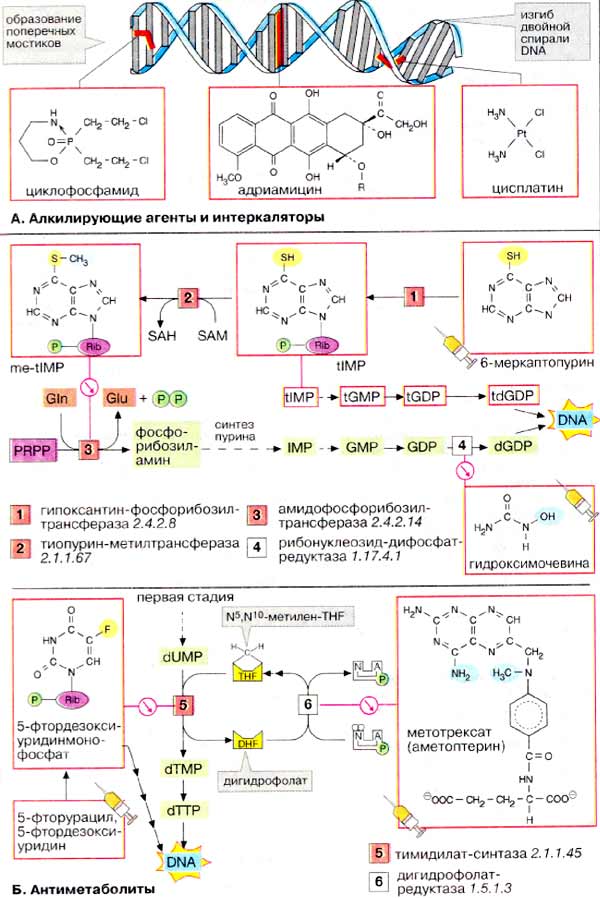
А. Алкилирующие и интеркалирующие
агенты
К алкилирующим агентам относят химические соединения, образующие
ковалентные связи с нуклеиновыми основаниями. Если в таких веществах имеются
две реакционноспособные группировки, то в двунитевой ДНК (DNA) образуются внутри-
и межмолекулярные мостики, что приводит к изгибу двойной спирали. В качестве
примера можно привести циклофосфамид и неорганический комплекс цисплатин.
Интеркалирующие агенты, такие, как адриамицин встраиваются между плоскостями
нуклеиновых оснований за счет нековалентных связей и вызывают локальные изменения
пространственной структуры ДНК (см. с. 250, Б).
Б. Антиметаболиты
Антиметаболитами называют ингибиторы
ферментов (см. с. 100), избирательно блокирующие метаболические пути.
Большинство важных в клиническом отношении цитостатиков вмешиваются в биосинтез
нуклеотидов. Многие из них являются производными нуклеиновых оснований или
нуклеотидов и служат конкурентными ингибиторами соответствующих ферментов
(см. с. 100). Некоторые антиметаболиты встраиваются в ДНК и тем самым
препятствуют репликации.
Введенные в организм цитостатики
(помечены изображением шприца) часто действуют опосредовано, т. е. приобретают
активность в результате метаболической трансформации. Так, аналог аденина
6-меркаптопурин вначале превращается в мононуклеотид тиоинозинмонофосфат
[тИМФ ( tIMP )]. Из тИМФ через ряд промежуточных стадий получается тдГТФ (tdGTP)
(серосодержащее производное дГТФ), который встраивается в ДНК , где образует
поперечные связи и вызывает другие аномалии. Другим активным производным
6-меркаптопурина является S-метил-тИМФ, ингибитор
амидофосфорибозилтрансферазы (см. с. 190).
Гидроксимочевина избирательно
ингибирует рибонуклеотид-редуктазу (см. с. 192). Как ловушка свободных
радикалов это соединение нейтрализует тирозин-радикал, необходимый для
функционирования редуктазы.
Два других важных цитостатика
препятствуют синтезу тимина на стадии дезоксимононуклеотида (см. с. 192).
Дезоксимононуклеотид, образующийся из 5-фторурацила или соответствующего
нуклеозида, ингибирует тимидилат-синтазу. Ингибирование основано на том,
что атом фтора в пиримидиновом цикле не замещается на метильную группу. Кроме
того, фтор содержащий аналог встраивается в ДНК.
Для тимидилат-синтазы вспомогательным
ферментом является дигидрофолатредуктаза. Этот фермент принимает участие
в регенерации кофермента N5,N10-метилен-ТГФ
(N5,N10-methylene-ТНF): с потреблением НАДФН он
восстанавливает ДГФ (DHF) до ТГФ (THF). Аналог фолиевой кислоты
метотрексат, часто применяющийся цитостатик, является чрезвычайно
эффективным конкурентным ингибитором дигидрофолатредуктазы. Действие цитостатика
приводит к истощению клеток относительно
N5,N10-метилен-ТГФ и, следовательно, к остановке синтеза
ДНК .