


Биомолекулы. Аминокислоты
Аминокислотный анализ
 Разделение и анализ аминокислот и их
производных используются при определении аминокислотного состава белков,
секвенировании пептидов, а также с целью диагностики
нарушений аминокислотного и белкового обмена. В этом разделе рассматриваются два наиболее важных в практическом отношении метода аминокислотного анализа.
Разделение и анализ аминокислот и их
производных используются при определении аминокислотного состава белков,
секвенировании пептидов, а также с целью диагностики
нарушений аминокислотного и белкового обмена. В этом разделе рассматриваются два наиболее важных в практическом отношении метода аминокислотного анализа.
А. Ионообменная хроматография
свободных аминокислот
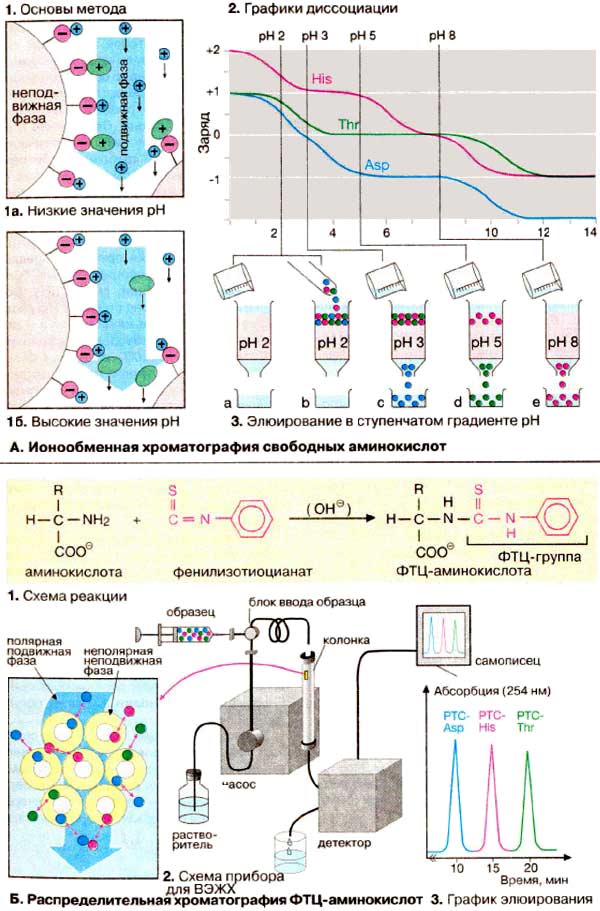
Ионообменная хроматография основана на электростатическом
взаимодействии между ионами противоположного заряда. Главное условие при
этом, чтобы ионы одного заряда были ковалентно фиксированы на инертном носителе.
Такой ионообменник будет связывать ионы противоположного заряда. При
промывании ионообменника раствором с более высокой ионной силой или иным значением
рН сорбированные ионы можно селективно перевести в раствор (элюировать).
При разделении аминокислот методом ионообменной хроматографии
в качестве неподвижной фазы используются гранулы синтетического полимера,
несущие сульфогруппы (-SО3-). Эти группы ионизированы
во всем диапазоне рН и несут отрицательный заряд. Для подготовки к работе ионообменник
помещают в колонку и промывают Na+-содержащим буферным раствором
с рН 2. При этом сульфогруппа (красный цвет) связывает ионы натрия (синий цвет).
Если теперь нанести на колонку раствор аминокислот (1а),
то положительно заряженные аминокислоты (зеленый цвет) вытеснят ионы натрия
и будут сорбированы на ионите. Поскольку аминокислоты не несут заряда в изоэлектрической
точке, их злюируют с колонки буфером с более высоким значением рН (1б).
В качестве примера приведен эксперимент (3) по
разделению аспарагиновой кислоты, треонина и гистидина. Графики титрования (2)
наглядно объясняют, почему три аминокислоты элюирутся в указанной последовательности.
Строго говоря, аминокислоты элюируются при
величинах рН, значительно ниже изоэлектрических точек, поскольку за связывание
с ионообменником конкурируют Na+-ионы буферного
раствора.
Б. Распределительная хроматография
ФТЦ-производных аминокислот
Распределительная хроматография основана на
различной полярности разделяемых веществ. Если на инертный
носитель нанести мапополярную неподвижную фазу, а затем смесь неполярных
веществ, то они будут удерживаться носителем за счет гидрофобного взаимодействия
(см. с. 34). Если такую колонку промыть смесью полярных растворителей
(подвижной фазой), то компоненты смеси будут перемещаться с различной
скоростью в зависимости от их полярности. Вначале будут элюироваться
гидрофильные вещества, слабо взаимодействующие с неподвижной фазой, а затем
гидрофобные вещества.
В первых вариантах распределительной
хроматографии гидрофильной была неподвижная фаза, а гидрофобной — подвижная.
Приведенная здесь современная модификация метода носит название
обращенно-фазовая хроматография (ОФХ).
Сначала при взаимодействии с
фенилизотиоцианатом получают производные аминокислот (1).
ФТЦ-аминокислоты (РТС-аминокислоты) малополярны и благодаря поглощению в
УФ-обпасти спектра их можно обнаруживать в элюате фотометрически. В качестве
неподвижной фазы используются мелкие частицы силикагеля (диаметром 5 мкм) с
привитыми углеводородными цепями (лигандами). Использование мелкодисперсных
носителей позволяет повысить качество разделения, однако при этом растет
механическое сопротивление колонки. Поэтому высокоэффективную жидкостную
хроматографию (ВЭЖХ) проводят в капиллярах или колонках, выполненных из
нержавеющей стали, а элюент подают с помощью насосов высокого давления (2). В
качестве элюентов используются системы растворителей с возрастающей
концентрацией ацетонитрила (СН3СN). Состав подвижной фазы, а
следовательно, и качество разделения (3) оптимизируют с помощью программируемых
градиентных смесителей.