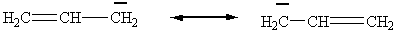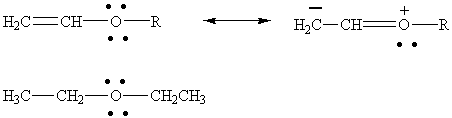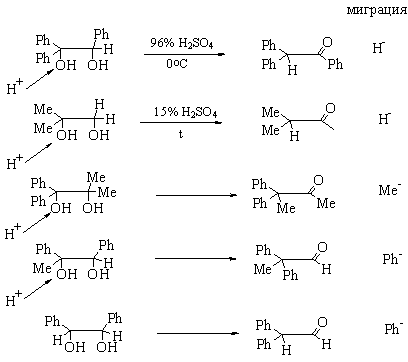|
Основные учебные курсы
для студентов Химического факультета МГУ
Органическая химия
Подробная программа лекций и
комментарии к первой части курса
Подробная
программа курса лекций (далее ППК) создана на основе Программы общего курса
органической химии, разработанной на кафедре органической химии химического
факультета МГУ и утверждённой методической комиссией. ППК раскрывает наполнение
общего курса лекций фактическим материалом по теории и практике органической
химии. ППК предназначена в первую очередь для студентов 3 курса, желающих лучше
и достаточно быс`тро подготовиться к экзаменам и коллоквиумам и понять, какой
объём знаний должен иметь студент для получения отличной оценки на экзамене.
ППК подготовлена таким образом, что обязательный материал программы напечатан
нормальным шрифтом, факультативный материал –
курсивом.
Одной из целей
данного пособия является помощь
студентам правильно и аккуратно составить конспект лекции, структурировать
материал, сделать правильные акценты в записи, отделить обязательный материал
от второстепенного при самостоятельной
работе с конспектом или учебником. Необходимо отметить, что несмотря на
широчайшее распространение современных методов обучения и доступность
разнообразного учебного материала в учебниках и в Интернете, только
самостоятельная упорная, если не сказать тяжёлая работа по конспектированию
(лекций, учебников, других материалов), работа на семинарах, самостоятельное
написание важнейших уравнений и механизмов, и самостоятельное решение
синтетических задач способно привести к успеху в изучении органической химии
(да и других предметов тоже). Автор считает, что прослушивание курса лекций
даёт основу для изучения органической химии и охватывает все темы, выносимые на
экзамен. Однако, прослушанные лекции, равно как и прочитанные учебники остаются
пассивным знанием до тех пор, пока не произойдёт закрепление материала на
семинарах, коллоквиумах, при написании тестов, контрольных работ и анализе
ошибок. В ППК практически отсутствуют уравнения химических реакций (за
исключением некоторых второстепенных) и механизмы важнейших процессов. Этот
материал доступен на лекциях и из учебников. Каждый студент должен добывать
какие-то знания самостоятельно: написать важнейшие реакции, механизмы и лучше
не один раз (самостоятельная работа с конспектом лекций, с учебником,
коллоквиум). Только то, что приобретается путём самостоятельной кропотливой
работы запоминается надолго и становится активным знанием. То, что легко
достаётся – легко теряется или забывается, причём это справедливо не только по
отношению к курсу органической химии.
Помимо
материалов программного характера данная разработка содержит ряд
вспомогательных материалов, которые демонстрировались на лекциях и которые
необходимы, по мнению автора, для лучшего понимания органической химии. Эти
вспомогательные материалы (цифры, таблицы и др., даже если они напечатаны
нормальным шрифтом) чаще всего не предназначены для буквального запоминания, но
нужны для оценки тенденций изменения свойств или реакционной способности
органических соединений. Поскольку демонстрируемые на лекциях вспомогательные
материалы, цифры, таблицы бывает трудно полностью и качественно записать в
конспект, размещение этих материалов в данной разработке имеет целью помочь
слушателям курса восполнить пробелы в записях и конспектах, а на лекции
сосредоточиться не на стенографировании цифр и таблиц, а на восприятии и
понимании материала, обсуждаемого лектором.
Помимо этих
сведений ППК содержит краткие комментарии лектора к наиболее трудным разделам
программы.
Материалы к вводной лекции по органической химии (1 час, половина лекции.)
Нобелевские премии по органической химии
|
1902
|
Герман Эмиль Фишер
|
"За эксперименты по синтезу
веществ с сахаридными и пуриновыми группами".
|
|
1905
|
Адольф фон Байер
|
"За заслуги в развитии
органической химии и химической. промышленности благодаря работам по
органическим красителям и гидроароматическим соединениям".
|
|
1910
|
Отто Валлах
|
"В знак признаний его
достижений в органической химии и химической. промышленности, а также за то,
что он первым осуществил работу в области алициклических соединений".
|
|
1912
|
Виктор Гриньяр
|
"За открытие реактива
Гриньяра, способствовавшего развитию органической химии".
|
|
Поль Сабатье
|
"За метод гидрогенизации
и органических соединений в
присутствии мелкодисперсных металлов.
|
|
1915
|
Рихард Мартин Вильштеттер
|
"За исследования красящих
веществ растительного мира, особенно хлорофилла".
|
|
1923
|
Фриц Прегль
|
"За изобретение метода
микроанализа органических веществ".
|
|
1927
|
Генрих
Виланд
|
"За исследования желчных
кислот и строения многих сходных веществ".
|
|
1928
|
Адольф Виндаус
|
"За работы по изучению
строения стеринов и их связи с витаминной группой".
|
|
1930
|
Ханс Фишер
|
"За исследования по
конструированию гемина и хлорофилла.".
|
|
1937
|
Уолтер Хоуорс
|
"За исследования углеводов
и витамина С".
|
|
Пауль Каррер
|
"За исследование
каротиноидов и флавинов, за изучение витаминов А и В2".
|
|
1938
|
Рихард Кун
|
"В знак признания
проделанной им работы по каротиноидам и витаминам".
|
|
1939
|
Адольф Бутенандт
|
"За работы по половым
гормонам".
|
|
Леопольд Ружичка
|
"За работы по полиметиленам
и высшим терпенам".
|
|
1947
|
Роберт Робинсон
|
"За исследования растительных
продуктов большой биологической важности, особенно алкалоидов".
|
|
1950
|
Отто Дильс
Курт Альдер
|
"За открытие и развитие
диенового синтеза".
|
|
1953
|
Герман Штаудингер
|
"За исследования в области
химии высокомолекулярных веществ".
|
|
1963
|
Карл Циглер
Джулио Натта
|
"За открытие
изотактического полипропилена".
|
|
1965
|
Роберт Вудворд
|
"За выдающийся вклад в
искусство органического синтеза".
|
|
1969
|
Дерек Бартон
Одд Хассель
|
"За вклад в развитие
конформационной концепции и её применение в химии".
|
|
1973
|
Эрнст Отто Фишер
Джефри Уилкинсон
|
"За новаторскую,
проделанную независимо друг от друга, работу в области химии металлоорганических,
так называемых сэндвичевых, соединений".
|
|
1975
|
Джон Корнфорт
|
"За исследование
стереохимии реакций ферментативного катализа".
|
|
Владимир Прелог
|
"За исследования в области
стереохимии органических молекул и реакций".
|
|
1979
|
Герберт Браун
Георг Виттиг
|
"За разработку новых
методов органического синтеза сложных бор- и фосфорсодержащих соединений".
|
|
1984
|
Роберт Меррифилд
|
"За предложенную
методологию химического синтеза на твердых матрицах".
|
|
1987
|
Доналд Крам,
Жан Мари Лен,
Чарлз Педерсен
|
"За разработку и применение
молекул со структурно-специфическими взаимодействиями высокой
избирательности" (Супрамолекулярная химия).
|
|
1990
|
Элайс Кори
|
"За развитие теории и
методологии органического синтеза".
|
|
1994
|
Джордж Ола
|
"За вклад в химию
углерода".
|
|
1996
|
Роберт Керл,
Харолд Крото
Ричард Смелли
|
"За открытие фуллеренов".
|
|
2001
|
Уильям Ноулз,
Риоджи Нойори
Барри Шарплесс
|
"За исследования,
используемые в фармацевтической промышленности — создание хиральных
катализаторов окислительно-восстановительных реакций".
|
|
2005
|
Роберт Граббс,
Ричард Шрок,
Ив Шовен
|
"За вклад в развитие метода
метатезиса в органическом синтезе".
|
Нобелевские премии по химии (разделение по областям химии условно).
Органическая химия –
28
Физическая
химия (включая кинетику химических реакций, строение вещества, природу
химической связи – 25
Биологическая химия – 23
Неорганическая химия, включая радиохимию, – 14
Методы
анализа (ЯМР, хроматография, масс-спектроскопия и рентгеноструктурный анализ) –
6. Важность методов анализа для установления строения органических веществ
Химическая
технология – 2. Именно химическая технология позволяет довести научные
разработки до практического результата.
ВАЖНЕЙШИЕ УЧЕБНИКИ ПО
ОРГАНИЧЕСКОЙ ХИМИИ
1.
О.А.Реутов,
А.Л.Курц, К.П.Бутин. Органическая химия. М.: Изд. МГУ, Изд. "Бином", 1999-2002,
т.1-4.
2.
Ю.С.Шабаров.
Органическая химия. М.: Химия, 1994, т.1,2.
3.
Д.Робертс,
М.Кассерио. Основы органической химии. М.: Мир, 1981, т.1,2.
4. А. Терней.
Современная органическая химия. М.: Мир, 1981, т.1,2.
5. Р.Морриссон,
Р.Бойд, Органическая химия. М.: Мир, 1974.
6. А.Н.Несмеянов,
Н.А.Несмеянов. Начала органической химии. М.: 1974, т.1,2.
7.
ОРГАНИКУМ
(Х.Беккер, Г.Домашке, Э.Фангхенель), М.: Мир, 1974.
ЗАДАЧНИКИ:
1) Задачи
по органической химии с решениями (А.Л.Курц, М.В.Ливанцов, А.В.Чепраков,
Л.И.Ливанцова, Г.С.Зайцева, М.М.Кабачник). М.: Бином. 2004.
2) Задачи и упражнения по органической химии (А.Е.Агрономов,
И.Г.Болесов, В.М.Потапов, В.Л.Фосс, С.С.Чуранов, Ю.С.Шабаров). Изд-во МГУ.
1971.
ДОПОЛНИТЕЛЬНАЯ
ЛИТЕРАТУРА.
1.
Ф.Кери, Р.Санберг.
Углублённый курс органической химии. М.: Химия, 1981.
2.
Д.Марч.
Органическая химия. М.: Мир. 1987-1988. т.1-4.
3.
Л.Физер,
М.Физер. Органическая химия. М.: Химия, 1970.
4.
В.М.Потапов.
Стереохимия. М.: Химия. 1978 или поздние переиздания.
5.
П.Сайкс.
Механизмы реакций в органической химии. М. Химия, 1991.
СТЕРЕОХИМИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Основные понятия. 1 час, пол-лекции.
- Предметы,
не имеющие элементов симметрии. Хиральность.
- Молекулы,
не имеющие элементов симметрии. Связь с гибридизацией углерода. Асимметрические
центры. Энантиомеры. Рацематы. Рацемизация. Могут ли атомы азота или фосфора в аминах и фосфинах быть
асимметрическими центрами?
- Поляризация
света. Что такое плоско-поляризованный свет (ППС)?
Различия в
свойствах энантиомеров. Когда они могут проявиться?
- Циркулярно-поляризованный
свет. Плоскополяризованный свет как
сумма правого и левого циркулярно-поляризованного света.
Причина возникновения вращения
ППС – разная скорость прохождения правого и левого циркулярно-поляризованного
света в оптически активном веществе (разный показатель преломления по отношению
к циркуляно поляризованному свету – правому и левому. Обнаружено на кристаллах
кварца (Френель 1823 г.).
- Измерение
угла оптического вращения. Принцип устройства прибора. Формула для определения удельного
вращения.[a]tl
=100 a/lc, с – грамм на 100 мл, l – длина
в дм, l
- D-линия спектра Na, 589 нм.
- Изображение
тетраэдрического атома углерода в проекции на плоскости. Клиновидные проекции, "лесопильные
козлы", проекции Ньюмена. Формулы Фишера. Правила обращения с формулами
Фишера (на лекции разбираются кратко, подробно – на семинаре).
- Абсолютная
конфигурация. R/S-номенклатура Кана-Ингольда-Прелога.
Определение порядка старшинства заместителей у асимметрического атома
углерода (подробно разбирается на семинаре).
- Случай
нескольких асимметрических атомов. Максимальное число стереоизомеров для
соединений с несколькими асимметрическими атомами. Пример - винные кислоты.
Диастереомерные и энантиомерные пары на примере винных кислот.
- Можно
ли предсказать знак и величину оптического вращения, зная абсолютную
конфигурацию? (Не существует
простых и универсальных способов – буквы R и S не обозначают знак вращения).
10. Важность
синтеза индивидуальных оптических изомеров для фармакологии. История талидомида.
11.
Хиральность без присутствия асимметрических центров. Оси и
плоскости хиральности – примеры молекул с такими типами хиральности.
ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ В ОРГАНИЧЕСКОЙ ХИМИИ.
(только семинары в группах)
- Природа
индуктивного эффекта. Классификация основных заместителей по знаку и
относительной величине (сильный, слабый) индуктивного эффекта.
- Природа
резонансного (мезомерного) эффекта. Способы обозначения резонансного
эффекта (резонансные структуры, кривые стрелки). Правила написания
резонансных структур (атомы
неподвижны, перемещаются только электронные пары или неспаренный электрон,
правило октета). Примеры групп с +М, -М эффектами.
- Анализ
влияния заместителей (сочетание
индуктивного и резонансного эффектов, только индуктивные заместители,
примеры заместителей с противоположными эффектами) на типичные
свойства (стабильность катионов, анионов, кислотность и основность органических соединений).
(Эти темы подробно разбираются только на семинарах по
органической химии во вводном концентре. Однако, к сожалению, даже ко времени
первого экзамена по органической химии многие студенты не могут правильно изобразить
предельные структуры для простейших органических молекул, ионов и групп. В
связи с этим, представляется
целесообразным привести здесь предельные структуры для простейших ионов и
групп, таких как:
1)
Аллил катион (аналогичные структуры встречаются при написании
предельных структур для бензил- катиона, бензолониевых катионов (тема –
электрофильное замещение в аренах. При этом необходимо учитывать дополнительную
возможность делокализации по бензольному кольцу.).
Возможно использовать два
основных способа отображения резонанса:
а) с помощью резонансных структур
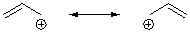
Очень важно усвоить, что
резонансная стрелка – особый тип обозначения, который нельзя путать со
стрелками, использующимися для обозначения реакций и равновесий.
Резонансные структуры – это не
реальные изомеры, а гипотетические предельные структуры;
б) с помощью кривой стрелки,
показывающей направление смещения пары.
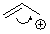
Очень нежелательно смешивать эти
два способа, то есть писать что-то вроде
Иногда используют и еще один
способ – показывают делокализацию пунктиром, отмечая связи с дробным порядком
одним из трех вариантов.
Хотя такие формулы и можно
встретить во многих учебниках, использовать их нежелательно, так как при этом
трудно показать между какими атомами происходит делокализация, особенно для
более сложных, чем аллильная, систем.
2)
Для радикальных частиц, например, аллильного радикала
использование резонанса аналогично, но при использовании кривых стрелок
делокализацию неспареного электрона показывают односторонней стрелкой
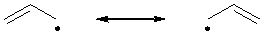 или или 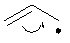 . .
3)
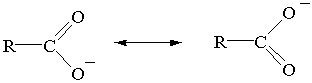
Аллил анион (встречается редко), однако очень похожие анионы –
карбоксилат анион, енолят анион, встречаются очень часто. Подобное было и в
курсе неорганической химии, например карбонат анион.
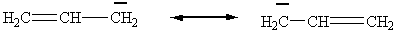
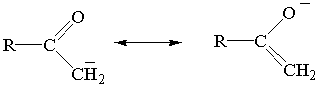
4)
Убедиться, что для пропил-катиона, пропил-радикала и
пропил-аниона мезомерной делокализации заряда или неспаренного электрона нет и
подобные предельные структуры не могут быть написаны.
5)
Винилэтиловый и диэтиловый эфир (в последнем случае мезомерной
делокализации нет!). Изображать обе пары
неспаренных электронов кислорода в виниловом эфире не обязательно. Достаточно
изобразить одну пару, которая участвует в сопряжении с двойной связью.
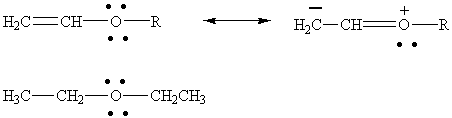
6)
Предельные структуры для карбонильной группы.
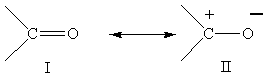
Необходимо помнить, о строгом соблюдении правила октета при
написании предельных структур: вокруг атома элемента второго периода неможет быть
больше восьми электронов. Меньше восьми электронов может быть, но тогда может появляться заряд
или неспаренный электрон: например атом углерода, имеющий семь электронов –
метил радикал; атом углерода, имеющий шесть электронов (секстет) может иметь
заряд +1 (метил-катион или атом
углерода в предельной структуре пункта
6 – II, но может и не
иметь заряда (например в нестабильной молекуле, называемой "карбен", см. ниже в
теме алкены, п. 20).
АЛКАНЫ СnH2n+2 (2 лекции)
1.Общие сведения,
физические свойства, гомология, изомерия.
2.Строение, природа
С-С и С-Н связей, геометрия молекулы, межатомные расстояния
3.Вращение вокруг C-C связей. Понятие о конформациях на примере
конформаций этана и бутана. Проекции в виде "кóзел", проекции Ньюмена.
Понятие о пространственных препятствиях. Конформации гош-, анти-, заслоненные. Энергетические диаграммы. НЕ ПУТАТЬ КОНФОРМЕРЫ и ИЗОМЕРЫ!
4.Физические
свойства алканов (кратко). Связь
физических свойств и строения на примере пентана и неопентана..
5.Гомо- и
гетеролитический разрыв связи.
6.Радикальные
реакции алканов. Хлорирование метана. История открытия. Энергетика процесса.
Инициирование радикальной реакции (термическое, фотохимическое, с помощью
инициаторов). Энергия видимого и УФ света – оценка энергии, необходимой для
гомолитического расщепления связи в галогенах. Механизм цепной радикальной
реакции: стадии реакции (зарождение, развитие, обрыв цепи.) Энергетика каждой
стадии. Выбор оптимального интермедиата. Хлорирование этана.
7.Относительные
скорости хлорирования С-Н связей различного типа (первичных, вторичных,
третичных) с учетом статистического фактора . Хлорирование изобутана. Строение
алкильных радикалов, их стабильность. Гиперконъюгация. Энергия первичных,
вторичных, третичных С-Н связей. Избирательность (селективность) хлорирования и
бромирования алканов – сравнение, причины различия. Избирательность реакции и
температура. О возможности фторирования и иодирования алканов.
8.Другие
радикальные реакции алканов. Сульфохлорирование. Нитрование по Коновалову. Чем отличается
крекинг термический от каталитическиого? Окисление, горение. Наблюдение
образования алкильных радикалов (Панет). Тетраэтилсвинец. Двигатель внутреннего
сгорания и дизельный двигатель.
9.Распространение
алканов в природе и их источники. Применение алканов.
10.
Электрофильные реакции алканов – дейтерообмен, скелетная
изомеризация нормальных алканов, образование карбокатионов. Работы Дж.Ола
(Нобелевская премия 1994 г) - суперкислотные среды, катион метония.
Трехцентровая двухэлектронная связь. Отличие между карбениевыми и карбониевыми
ионами.
11.
Методы получения алканов: 1) реакция Вюрца (практически
полностью утратила значение!), 2) использование купратов, 3) гидрирование С=С
связи.
12.
Методы синтеза алканов которые будут изучены позже: (из
реактивов Гриньяра, реакция Кольбе, декарбоксилирование солей карбоновых
кислот).
ПОВТОРЕНИЕ ВАЖНЕЙШИХ ХИМИЧЕСКИХ ПОНЯТИЙ и ПРИНЦИПОВ,
которые были
рассмотрены в лекциях по химии алканов.
- Химические реакции протекают через
образование наиболее стабильных интермедиатов.
- Лёгкость протекания реакции (т.е. скорость
реакции) зависит не от теплового эффекта реакции, а от величины энергии
активации! Для оценки скорости протекания реакции необходимо учитывать
пространственный фактор (т.е. пространственные препятствия при образовании
переходного состояния).
- Для выводов о направлении реакции и
соотношении продуктов необходимо учитывать статистический фактор. Нельзя
избирательно получить СН3(СН2)nСН2С1
хлорированием н-СН3(СН2)nСН3.
- Как правило, увеличение температуры
снижает избирательность процесса.
Менее реакционноспособные реагенты реагируют более избирательно.
ПРИМЕНЕНИЕ СПЕКТРАЛЬНЫХ МЕТОДОВ ИССЛЕДОВАНИЯ В
ОРГАНИЧЕСКОЙ ХИМИИ. Метод ядерного магнитного резонанса (1 лекция).
АЛКЕНЫ (4 лекции).
1.
Электронное строение
двойной связи С=С. Гибридизация атома углерода. Строение этилена длины
связей, углы). Энергия π– и σ – связи в этилене. Геометрическая изомерия. (цис-транс- и Z/E- номенклатура). Отличие конформеров (алканы) и геометрических
изомеров. Относительная термодинамическая стабильность цис- и транс- изомеров
бутена-2.
2.
Зависимость стабильности алкенов от степени замещения двойной
связи (бутен-1 и бутен-2) – оценка относительной стабильности из теплот
гидрирования. Факторы, влияющие на энергию двойной связи – гиперконъюгация и
стерические факторы (в цис-алкенах).
3.
Гетерогенное и гомогенное гидрирование алкенов. Гетерогенные
катализаторы на основе соединений металлов платиновой группы. Пример гомогенного катализатора – комплекс
Уилкинсона (работает при 20оС, 1 атм). Никель Ренея. Стереохимия
гидрирования.
4.
Понятие о нуклеофильных и электрофильных и реагентах.
Электрофильно-нуклеофильные реакции приводят к образованию
ковалентной связи. Реагент, который отдает пару электронов на образование
связи, называется нуклеофилом. Реагент, который принимает пару электронов,
называется электрофилом.
Нуклеофилы (Nu) – ионы, имеющие отрицательный заряд, или нейтральные
молекулы, имеющие неподелённую пару электронов.
Электрофилы (Е) – ионы, имеющие
положительный заряд, или нейтральные молекулы, способные реагировать с
нуклеофилами.
5.
Электрофильное присоединение к алкенам. Почему именно
электрофилы, а не нуклеофилы легко присоединяются по неактивированной С=С
связи? Объяснение "школьное" и с использованием метода МО. ВЗМО и НСМО этилена.
Общее представление о механизме реакций, π- и σ-комплексы, ониевые ионы, скоростьопределяющая стадия. Стереоселективность процесса. AdE2 и AdE3 механизмы.
Мостиковые и открытые ионы. Когда они бывают?
6.
Присоединение хлора и брома к алкенам. Механизм, стереохимия,
влияние заместителей на стереохимию присоединения (1-фенилпропен). Связь стереохимии
присоединения с возможностью существования мостиковых ионов. Пример -
присоединение брома к цис- и транс-бутенам-2. Образование мезо- формы
(эритро-изомеров) и рацемата (трео-изомеры).
7.
Гидрогалогенирование. Региоселективность электрофильного присоединения
к алкенам. Правило Марковникова. Примеры. Поляризация исходной молекулы алкена.
Стабильность интермедиата (карбокатиона). Не
путать переходное состояние и интермедиат! Влияние заместителей при С=С
связи на скорость присоединения. Откуда электрофил "знает" куда ему идти – т.е.
какой атом углерода атаковать? Пример применения постулата Хэммонда для стадии
присоединения положительно-заряженного электрофила к двойной связи –
стабильному катиону соответствует более выгодное переходное состояние. Примеры: присоединение галогеноводородов к
стиролу, виниловым эфирам и винилхлориду.
8.
Исключения из формальногоправила
Марковникова (1)присоединение к электронодефицитным алкенам, (2) присоединение
боранов, (3) радикальное присоединение. Различные формулировки правила
Марковникова:
Важно: Необходимо различать формальную формулировку правила
Марковникова, сформулированного в 19 веке задолго до появления понятий об
электронной структуре, донорах и акцепторах, механизмах реакций, от современных
трактовок механизма электрофильного присоединения. Когда говорят, что
присоединение идет против правила Марковникова (антимарковниковское
присоединение), всегда имеют в виду первоначальную формулировку правила
“Реагент HXприсоединяется к несимметричному олефину так, чтобы водород
присоединился к наиболее гидрогенизованному (наименее замещенному), а X – к наименее
гидрогенизованному (наиболее замещенному)”. Обратите внимание, что в этой
формулировке не рассматривается ни природа реагента HX, ни эффекты заместителей в олефине.
Поэтому, например, а) гидроборирование; б) присоединение бромоводорода к
акриловой кислоте и другим олефинам с акцепторными группами называется
антимарковниковским, хотя механизмы этих реакций полностью соответствуют общей
схеме электрофильного присоединения и никаких реальных аномалий в этих
процессах нет. Расширительное толкование правила Марковникова иногда включает и
реагенты общего вида EN
(где E –
электрофильный, а N –
нуклеофильный центры реагента), но этот подход может приводить к
недоразумениям.
9. Электрофилы, отличные от протона. Почему RSCl даёт М+АМ?
10.
Выводы по стерео- и
региохимии электрофильного присоединения к алкенам. Образование циклических
ониевых ионов при электрофильном присоединении к алкенам постулируется на
основании кинетических и стереохимических
исследований для случаев, когда электрофилом является Br+, Cl+, I+, AcOHg+, RSCl, RSeCl и т.п. В некоторых случаях удается наблюдать образование
таких мостиковых ионов спектрально (в случае Br+, RS+,
AcOHg+),
что, однако, не является доказательством, что подобные “мостики” образуются
всегда.
Можно вывести следующие закономерности AdE реакций, проходящих через мостиковые ониевые катионы
или ациклические карбокатионы: Симметричный “мостик” → анти-
присоединение, региоселективности нет. Несимметричный “мостик” → анти- присоединение, возможно появление син-
продукта, региоселективность есть (правило Марковникова). Нет “мостика”
(например, для протона) →
региоселективность есть (правило Марковникова), стереоселективность есть для AdE3 (анти-), стереоселективности нет для AdE2 (смесь син- и анти-). Мостика может не быть и в том
случае, когда возможно образование стабильного карбокатиона, например, в случае
присоединения Br2 к 1-фенилпропену - стереоселективности нет,
образуются син- и анти- аддукты.
12. Побочные реакции при электрофильном присоединении к алкенам:
сопряжённое присоединение нуклеофила (например, образование бромгидринов при
взаимодействии олефинов с бромом в водной среде), перегруппировки
интермедиатов, карбениевых ионов (гидридные и алкильные сдвиги).
13.
Кислотно-катализируемая гидратация алкенов. Условия и
ограничения. Альтернативный непрямой метод гидратации – гидроксимеркурирование.
Алкоксимеркурирование.
14.
Регио- и стереоселективное присоединение гидридов бора
(боранов). Региоспецифические гидроборирующие агенты (дисиамилборан, тексилборан, 9-ББН). Какие функциональные группы
могут и не могут быть в молекуле алкена, которая подвергается гидроборированию?
Превращение борорганических соединений в алканы, спирты, алкилгалогениды. Селективное
введение дейтерия как демонстрация возможностей метода.
15.
Озонолиз алкенов. Окислительное и восстановительное
расщепление озонидов.
16. Окисление
алкенов до диолов (гидроксилирование) по Вагнеру (перманганат калия, 1-2%
раствор рН 7-8), Криге (тетраоксид осмия, затем NaHSO3, желательно также
иметь представление о каталитическом варианте гидроксилирования OsO4 с
использованием дешевых стехиометрических реокислителей, например, N-оксидов аминов или красной
кровяной соли). Принципы и катализаторы стереоселективного
гидроксилирования по Шарплесу. Гидроксилирование через гидролиз эпоксидов
по Прилежаеву. Стереохимия гидроксилирования алкенов. Доказательства отдельных
стадий син- и анти-
гидроксилирования промежуточные продукты при син- и анти- гидроксилировании.
17.
Свободнорадикальные реакции: История вопроса, присоединение
бромистого водорода по Харашу,
инициаторы реакции, механизм. Почему не присоединяются радикально HF, HI?
Присоединение H2S, RSH к алкенам. Аллильное
галогенирование: получение хлористого аллила из пропилена в газовой фазе,
аллильное бромирование по Волю-Циглеру.
18. Молекулярные π-орбитали аллильной
системы.
19.
Карбены. Методы генерирования. Понятие о синглетных и
триплетных карбенах, их строение, гибридизация, углы между связями, Стереохимия
присоединения к алкенам. Карбеноиды. Реагент Симмонса-Смита.
20.
Полимеризация алкенов (катионная, анионная, радикальная).
СИНТЕЗ АЛКЕНОВ.
1. РЕАКЦИИ
ЭЛИМИНИРОВАНИЯ (подробно – в лекциях по элиминированию).
а) дегидрогалогенирование алкилгалогенидов по Зайцеву и по
Гофману. Отличия в селективности будут рассмотрены в теме Элиминирование.
б) дегидратация спиртов под действием серной, фосфорной или
др. кислот (например, щавелевой). Часто осложняется полимеризацией и скелетными
перегруппировками.
в) дегалогенирование вицинальных дигалогенидов под действием
Zn, NaI или трифенилфосфина.
2. СТЕРЕОСЕЛЕКТИВНОЕ
ВОССТАНОВЛЕНИЕ АЛКИНОВ (подробно – в теме "Алкины".)
а) гидрирование на катализаторе Линдлара. (ЦИС-алкены)
б) гидроалюминирование (ДИБАЛ-Н, затем спирт). (ЦИС-алкены)
в) гидроборирование (замещенные бораны, затем АсОН) (ЦИС -алкены).
г) Na
в жидком аммиаке (интернальные ТРАНС-алкены).
3. ОБРАЗОВАНИЕ С=С
СВЯЗИ В РЕАКЦИЯХ ВИТТИГА И ХОРНЕРА.
подробно – в теме "карбонильные соединения").
4. МЕТАТЕЗИС
АЛКЕНОВ (подробно – в теме "Реакции, катализируемые комплексами
переходных металлов"). Используется как в промышленности, так и в тонком
органическом синтезе. Катализаторы – карбеновые комплексы переходных металлов.
5. РЕАКЦИЯ ХЕКА (подробно
– в теме "Реакции, катализируемые комплексами переходных металлов"). Синтез арилзамещенных алкенов из
арилиодидов и алкенов в присутствии
основания и Pd-катализатора.
6.КРЕКИНГ АЛКАНОВ
(тема - алканы). ДЕГИДРИРОВАНИЕ
АЛКАНОВ на Pt или Pd катализаторе. Используются только в промышленности.
Дополнительный материал по
электрофильному присоединению к алкенам. (для тех кто собирается распределяться
на кафедру органической химии или химии нефти.)
Некоторые закономерности
присоединения RSCl и RS+BF4- к алкенам. Равновесие
ковалентных сульфуранов и различных ионных пар на основе эписульфониевых ионов.
“Допинг” эффект LiClO4.
(Работы Н.С.Зефирова и В.А.Смита (ИОХ), см учебник О.А.Реутова,
А.Л.Курца и К.П.Бутина, т.1, стр.390).
Катализ электрофильного
присоединения к алкенам с помощью SO3 .
(Н.С.Зефиров, А.С.Козьмин, Н.В.Зык).
Например Cl2 + SO3 (-78oC, CH2Cl2)
®® Cl-O-SO2-Cl.
присоединяется к алкенам уже
при –78оС. Аналогично можно повысить электрофильность таких
реагентов, как R2NCl, RS-SR и др. (там же стр. 393).
“Экзотические” электрофильные
реагенты – HN3, IN3, I-N=C=O, NO-Cl, NCS-SCN (диродан).
АЛКИНЫ (2 лекции).
1.
Электронная природа тройной связи С≡С. Гибридизация
атома углерода. Строение ацетилена (длины связей, углы).
2.
ХИМИЧЕСКИЕ СВОЙСТВА. Гидрирование алкинов. Катализатор
Линдлара и Р-2-Ni. Восстановление
интернальных алкинов натрием в жидком аммиаке.
3. С-Н
Кислотность алкинов. Ацетилениды натрия, лития и меди. Получение и
использование в органическом синтезе. Особая роль ацетиленидов меди в
превращениях производных ацетиленов. Кросс-сочетание ароматических
иодпроизводных с ацетиленидами меди (некаталитическое - реакция Стефенса-Кастро, каталитическое - реакция Соногасиры, см.
ниже).
4. Электрофильное присоединение к алкинам.
Сравнение реакционной способности алкенов и алкинов. Общее представление о
механизме реакций. Галогенирование и гидрогалогенирование алкинов.
5. Гидратация алкинов (реакция Кучерова).
6. Регио- и стереоселективное присоединение
гидридов бора. Гидроалюминирование алкинов с ДИБАЛ-Н. Селективное введение
изотопов водорода как демострация возможностей метода. Региоспецифические гидроборирующие агенты (дисиамилборан, тексилборан, 9-ББН).
Превращение борорганических производных
в алкены, карбонильные соединения.
7.
Ацетилен-алленовая изомеризация. Смещение тройной связи в терминальное
положение (zipper-реакция). Реагенты для
смещения тройной связи в терминальное положение.
8. Окисление алкинов с
разрывом тройной связи.
9. Окислительная димеризация терминальных алкинов в
присутствии соединений меди.
10. Нуклеофильное присоединение к алкинам. Почему алкины
легче вступают в реакции нуклеофильного присоединения чем алкены. Синтез
виниловых эфиров.
11. Три- и тетрамеризация ацетилена на Ni-катализаторах.
СИНТЕЗ АЛКИНОВ (все - в теме “алкины”).
1. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ.
а) дегидрогалогенирование вицинальных дигалогенидов под
действием сильных оснований.
2. АЛКИЛИРОВАНИЕ АЦЕТИЛЕНИДОВ МЕТАЛЛОВ.
(Только для первичных RHal.
Плохо для втор., нельзя для трет. – закономерности определяются SN2-механизмом
реакции, см. ниже)
3. СИНТЕЗЫ С ИСПОЛЬЗОВАНИЕМ СОЕДИНЕНИЙ Cu(I) КАК КАТАЛИЗАТОРОВ ИЛИ
РЕАГЕНТОВ . (Реакции а) димеризации, б) окислительного сдваивания, в)
Стефенса-Кастро, г) Соногасиры (Cu-Pd-катализ.)
4. АЦЕТИЛЕН-АЛЛЕНОВАЯ
ПЕРЕНРУППИРОВКА (Фаворский). Синтез
терминальных алкинов из интернальных (КАРА, LAЕA (LAРA)).
5. РЕАКЦИЯ
ФАВОРСКОГО (КОН) –РЕППЕ (Cu2C2).
ДИЕНЫ (1 лекция).
1.
Диены: а) сопряжённые, б) аллены, в) несопряжённые. Длина сигма-
С-С связи в сопряженных диенах. Сопряжение и УФ- спектры. S-цис- и S-транс- конформации.
2. 1,2- и 1,4-присоединение к сопряженным
диенам. Энергетический профиль реакции.
Кинетически и термодинамически контролируемые реакции. (Электрофилы, которые не
дают 1,4-аддукты – RSCl,
карбены, ВН3, эпоксидирование).
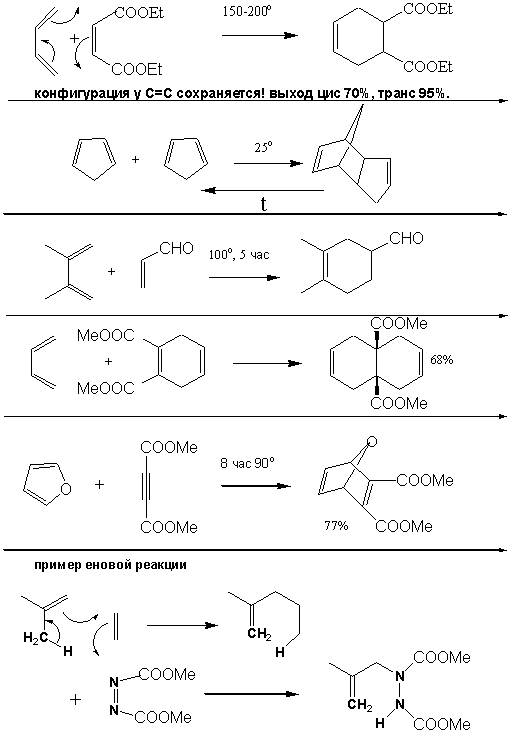
3. Реакция Дильса-Альдера как метод
образования С-С связей и метод синтеза 6-ти членных циклов. Диены и диенофилы. Необходимая конформация
нециклического диена. Механизм реакции (согласованное стереоспецифичное
[2+4]-циклоприсоединение). Реакция с циклическими диенами (циклопентадиеном,
циклогексадиеном). Экзо- и эндо- аддукты.
Реакции с ациклическими
несиметрично-замещенными диенами и олефинами - региоселективность и так
называемая “орто-пара-ориентация”.
4. Понятие
о согласованных перициклических реакциях. Разрешенные и запрещенные по
симметрии орбиталей процессы.
5. Понятие о еновой реакции. Аналогия между
механизмом диенового синтеза и еновой реакции.
6. Аллены. Хиральность тетразамещенных
алленов. Присоединение НBr к аллену.
7. Каучук.
МЕТОДЫ ПОЛУЧЕНИЯ СОПРЯЖЕННЫХ ДИЕНОВ.
1. А) БУТАДИЕН ИЗ
КАРТОФЕЛЯ (Лебедев, 30-е гг.): Картофель→крахмал→спирт →
бутандиол-1,3 → дегидратация в бутадиен-1,3. (Спирт на катализаторе Cr2O3/(ZnO)/Al2O3 при нагревании окисляется в ацетальдегид, последний
конденсируется в альдоль и восстанавливается в бутандиол-1,3 (тема – альдольная конденсация).
Б) БУТАДИЕН ИЗ АЦЕТИЛЕНА
И ФОРМАЛЬДЕГИДА по Фаворскому-Реппе.
В) ДЕГИДРИРОВАНИЕ С4
или С5 ФРАКЦИЙ, полученных при пиролизе нефтепродуктов с
последующей экстрактивной ректификацией (напр. с ДМФА.)
2. ХЛОРОПРЕН Димеризация НС≡СН в СН2=СН-С≡СН,
присоединение НСl (Cu2Cl2) по С≡С (старый способ).
3. ГИДРИРОВАНИЕ
СОПРЯЖЕННЫХ ДИИНОВ (С≡С-С≡С) с P-2-Ni/H2,
или с R2BH/потом AcOH. (СИН-гидрирование).
4. СИММЕТРИЧНЫЕ ДИЕНЫ.
Присоединение к С≡С гидридов бора (Sia2BH)
или алюминия (ДИБАЛ-Н) cпоследующей
окислительной димеризацией с Cu2Cl2 или Сu2Br2.
5.КРОСС-СОЧЕТАНИЕ.
RCH=CH-E (E= B, Sn, Zn) с Br-CH=CHR’ в присутствии Pd, или Niкатализаторов. (Тема – реакции, кат. Комплексами пер.
металлов.)
ПРИМЕРЫ РЕАКЦИЙ ДИЛЬСА-АЛЬДЕРА.
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АЛИФАТИЧЕСКОМ РЯДУ (3 лекции).
1.
Что такое нуклеофильное замещение. Типы нуклеофилов
(анионы,нейтральные молекулы, растворители). Уходящие группы.
2. Типы реакций
нуклеофильного замещения. 1) Y–
+ RX; 2) Y: + RX; более редкие случаи пока не обсуждали:
3) Y–
+ RX+,
например Вг– + R4N+
= RBr + R3N;
4) Y:
+ RX+, например R3N
+ R’SR”2 = R3NR’+ + SR”2.
3. Классификация
по механизму.
|
SN1
|
SN2
|
|
SN1, кинетическое ур-ние
|
SN2,
кинетическое ур-ние
|
|
Скорость реакции не
зависит от природы нуклеофила
и его концентрации
|
Скорость реакции зависит
от природы нуклеофила и его концентрации
|
|
Вид энергетического профиля реакции: двустадийный процесс
с участием промежуточного соединения (интермедиата). Скоростьопределяющая
стадия – гетеролиз связи с уходящей группой.
|
Вид энергетического профиля реакции: одностадийный
согласованный процесс. Нет интермедиатов. Переходное состояние – необходимо
точно понимать разницу между переходным состоянием и интермедиатом.
|
|
Чрезвычайно велика роль растворителя, так как именно этот
фактор имеет ключевое значение в процессе разрыва связи с уходящей группой.
Наиболее благоприятны растворители, сильно сольватирующие уходящие группы и
облегчающие гетеролиз – полярные
протонные растворители
|
Влияние растворителя зависит от нуклеофила – оно невелико
для нейтральных нуклеофилов (типа аммиака, аминов, и т.п.), и очень велико
для анионных нуклеофилов, вводимых в реакцию в виде солей. В этом случае
наибольшая реакционная способность достигается в апротонных растворителях высокой полярности.
|
|
Стереохимия: карбокатион плоский, атака нуклеофила с любой
стороны. Стереохимический результат – рацемизация (в реальных системах на стереохимию
влияет участие ионных пар, поэтому полная рацемизация встречается редко)
|
Всегда атака с тыла. Вальденовское обращение.
|
|
Пространственные факторы в первом приближении не важны. Однако переход от sp3
к sp2 уменьшает стерич.
отталкивание, что сильно чувствуется при очень объемных группах (напр. t-Bu (1) и t-Bu3C (13500), сольволиз
|
Пространственные факторы очень важны, см. многочисл.
примеры и п.4 ниже
|
|
В синтезе используется редко (превращение третичных
спиртов в бромпроизводные под действием концентрированной HBr, расщепление трет-бутиловых и
других трет-алкильных эфиров)
|
Очень широко используется в синтезе. Препаративные реакции
этого типа обычно называются алкилированием.
|
|
|
|
|
КОНКУРЕНТНО ПРОХОДИТ ЭЛИМИНИРОВАНИЕ, кроме случаев, когда R=Me, Allyl, Bn
или нет b–Н
атомов
|
4. Влияние структурных факторов в рядах Me- Et- i-Pr- t-Bu; Et- Pr- i-Bu- Np-.
Бициклические субстраты. Винил-, фенил-,
аллил- и бензил- галогениды в реакция НЗ. a –галогенкарбонильные
соединения.
4-MeO- и 4-NO2-бензилхлориды. Аллильная перегруппировка.
5. Природа нуклеофила. Нуклеофильность и основность.
Поляризуемость и сольватация нуклеофила. Мягкость и жесткость нуклеофила.
Конкуренция SN
и E реакций. a–эффект
и супернуклеофилы. "Голые" ионы. Межфазный катализ. Краун-эфиры, криптанды.
6. Природа растворителя. Влияние на SN1 и SN2. Ряд e:
диоксан (2.2), Et2O (4.22), моноглим (7.2), ТГФ
(7.4), ацетон (20.5), ГМФТА (30), ДМФ
(36.7), МеNО2
(38,6), сульфолан (44), ДМСО (49), e >
15 – биполярные, апротонные растворители. Они не должны содержать воды!!!
7. Уходящая группа.
Оценка Методы создания хорошей
УГ. Протонирование, эфиры сильных неорганических кислот, электрофильный
катализ, использование фосфорорганических соединений (Ph3P/CCl4, Ph3P/Br2, реакция Мицунобу).
8. Участие соседних групп. Иприт. Таблица (Беккер с. 198).
9. Кратко, факультативно: Более подробное рассмотрение механизмов НЗ. ("Интимные" (контактные) и
сольватно-разделенные ионные пары, солевые эффекты, случай SOCl2, суперкислые среды.
10-11. Важнейшие примеры синтетического использования
реакций НЗ.
11. Методы синтеза
алкилгалогенидов.
а) ROH
+ HHal;
б) ROH
+ PHal3 или
Р кр. + Hal2
и т.п.
в) ROH
+ SOCl2,
г) через OTs
пр-ные;
д) реакция Финкельштейна, включая р-ции RC1 с АgF, а также RBr + б/в КF в б/в этиленгликоле;
__________________________________________________
методы синтеза,
которые будут рассмотрены позднее.
е) реакция Хунсдикера (тема – карбоновые к-ты).
ё) галогенирование кетонов (тема – кетоны)
ж) из кетонов и РС15 → RCCl2R’ (тема –
кетоны)_______________________
методы синтеза,
которые уже были рассмотрены ранее.
з) галогенирование
алканов
и) присоединение ННаl, Наl2, НОНаl к олефинам,
к) реакции с использованием N-БСИ, N-ХСИ и N-ИСИ.
л) присоединение ССl2 и СВr2 к С=С
м) через гидроборирование
н) через Mg-
Li- или другие
металлорганические соединения.
НУКЛЕОФУГНОСТЬ НЕКОТОРЫХ ГРУПП Z в SN1
Сольволиз Ph-CHR-Z в 80% спирте.
|
АсО–
|
F–
|
Cl–
|
Br–
|
I–
|
TsO–, MsO–
|
TfO–
|
|
10-6
|
10-5
|
1
|
14
|
90
|
104
|
108
|
В SN2 реакциях
различие в нуклеофугности намного меньше!!!
Et–X + EtO– →→→ в спирте SN2, Et– O– Et
+ X–
|
Cl–
|
Br–
|
I–
|
TsO–, MsO–
|
|
0,02
|
1
|
2
|
6
|
ПОНЯТИЕ О "ЖМКО"
НУКЛЕОФИЛЫ
|
ЖЕСТКИЕ
|
МЯГКИЕ
|
|
1. маленький
(мальнькая поляризуемость)
2. заряженный
3. основный (HY – слабая к-та)
4. низкая энергия
ВЗМО
5. любит С=О (большой заряд!)
6. RO–,
NH2–, MeLi ит.п.
2.
|
1.
большой (большая поляризуемость)
2.
нейтральный (но м.б. и заряженный)
3.
не основный (HY
– сильная к-та)
4.
высокая энергия ВЗМО
5.
любит углерод sp3
6.
RS–, I–, R3P и т.п.
|
Жесткие кислоты – Al3+>Mg2+>Na+. Мягкие
кислоты : Ag+> Cd2+>Au3+> Sn4+.
Катионы Ж – сродство больше к F>O>N>Cl>I>S. Катионы М: сродство S>I>Br>Cl>N>O>F .
Наиболее прочные
соединения Ж+Ж или М+М.
РЕАКЦИИ ЭЛИМИНИРОВАНИЯ (1 лекция).
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ.
1.
α-элиминирование, β-ЭЛИМИНИРОВАНИЕ, γ-элиминирование
(карбены), (циклопропан)
2. Конкуренция SN и Е реакций. Не бывает для RX, где R=Me, Allyl, PhCH2 .
3. Механизм
элиминирования:
Е1 (сначала уходит
Х-, → катион,
строение → по Зайцеву),
→ Е1
подобное (связь С-Х ионизирована, С-Н – не затронута) → E2 подобное
→ Е2 (Н и Х
уходят одновременно),
→ E2
подобное, → Е1сВ подобное (связь
основания с Н сильная, связь Х с субстратом сильная. → по Гофману.
→ Е1сВ (через conjugate Вase, сначала уходит Н+
→ карбанион, строение алкена
4. ОСНОВНЫЕ
ЗАКОНОМЕРНОСТИ Е1.
1) Катион – общий с SN1. 2) V=k[RX]
3) соотношение Е к S растет с температурой, мало зависит от растворителя. Ненуклеофильный р-ритель способствует Е1. Ср-ть сольволиз t-BuCl и t-BuS+Me2.
4) Образование алкена
→ по правилу Зайцева
(более замещенный алкен – более ТМД стабильный). Не бывает 100% по Зайцеву!
5) Е1 – не
стереоселективно! 6) Низкая препаративная ценность.
5. ОСНОВНЫЕ
ЗАКОНОМЕРНОСТИ Е2.
1) V=k[B][RX]. Конкуренция Е и S. 2) теория перемен. перех.
сост. (см. п. 3).
3) Направление –
бывает по Зайцеву или по Гофману (терминальный алкен).
4) Что влияет на
соотношение Гофман-Зайцев (природа основания и уход. группы). 5) Стереохимия –
либо анти-, либо син-. Анти- бывает чаще (1-Х-циклогексан, 2-Х-бутан). Син- – реже (1-Х-циклопентан, 3-Х-гексан,
4-Х-октан). 6) Обр-е цис- и транс
алкенов. Не путать с син-/анти- элиминированием, п. 5-5)! 7) Элиминир. при
действии восстановителя (NaI).8)Пространственно
затруднённые амины и амиды для Е. 9) Дополнит.– элим. из сл. эфиров,
ксантогенатов (Чугаев) и N-окисей аминов (Коуп).
6. ОСНОВНЫЕ
ЗАКОНОМЕРНОСТИ Е1сВ.
1) Нужна хорошая электроноакцепторная
группа (NR3+,
NO2, CN, COOR, COR, SO2R, CF3)
2) V=k[B][RX] – второй порядок, но р-ция мономолекулярная (Е1!).
3) тест на Е1сВ – р-ция в D2O. См. D в исходном!
4) Направление –
кинетическая кислотность С-Н. Часто
– по правилу Гофмана.
ВЛИЯНИЕ ПРИРОДЫ УХОДЯЩЕЙ
ГРУППЫ И ОСНОВАНИЯ НА НАПРАВЛЕНИЕ Е2 ЭЛИМИНИРОВАНИЯ
|
СУБСТРАТ
|
ОСНОВАНИЕ, РАСТВОРИТЕЛЬ
|
% алкена-1
(Гофман)
|
% алкена-2,
Зайцев (транс/цис)
|
|
СН3(СН2)3СН(Z)CH3
|
|
|
|
|
Z=I
|
MeO-, MeOH
|
19
|
81(63/18)
|
|
Z=Br
|
MeO-, MeOH
|
25
|
75(57/18)
|
|
Z=Cl
|
MeO-, MeOH
|
33
|
67(50/17)
|
|
Z=OTs
|
MeO-, MeOH
|
30
|
70
|
|
Z=F
|
MeO-, MeOH
|
69
|
31(21/10)
|
|
Z=I
|
t-BuO-, t-BuOH
|
78
|
22(15/7)
|
|
Z=OTs
|
t-BuO-, t-BuOH
|
83
|
17
|
|
Z=Cl
|
t-BuO-, t-BuOH
|
91
|
9
|
|
Z=F
|
t-BuO-, t-BuOH
|
97
|
3
|
|
Z=N+Me3
|
t-BuO-, t-BuOH
|
98
|
2
|
ВЫВОД: Доля алкена-1 растет в ряду I<Br<Cl<OTs<F<+NR3
т.е. с ростом электроноакцепторных
свойств,
а также при увеличении силы основания
(из-за роста карбанионного характера
переходного состояния)
-OMe<-OBu-t<(-OCEt3
NaNH2, LDA).
ЭЛИМИНИРОВАНИЕ. ГЛАВНЫЕ ВЫВОДЫ.
1. Одни
и те же реагенты могут приводить к S и к Е.
2. Обычно
SN1 > E1, но это только сольволиз!
3. Для
SN2 и Е2:
i) чем более пространственно
затрудненные реагенты или субстраты,
тем больше Е2.
ii) Чем более сильное
основание и температура – тем больше Е.
iii) Чем больше полярность
р-рителя – тем больше SN(пример – КОН в воде (SN) и в спирте (E)).
4. Стереохимия:
анти- чаще син-; транс- алкена
больше, чем цис-.
5. Региохимия:
не бывает чистого элиминирования по Зайцеву, бывает чистое (т.е. > 92-95%) элиминирование
по Гофману. Сильные основания, пространственно затруднённые реагенты, плохие
уходящие группы, электроноакцепторные группы – способствуют элиминированию по
Гофману.
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (1
лекция)
МАГНИЙ-, ЛИТИЙ- и
МЕДЬОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ.
1.
Реактивы Гриньяра. Получение. Исходные галогениды. Природа
галогена. Особенности реакции Г. для н-алкил-, трет.-алкил-, аллил-, бензил-, винил- и арилгалогенидов,
1,1-, 1,2-, 1,3- и 1,4-дигалогенидов. Растворители. Сольваты. Понятие о
механизме образования. Равновесие Шленка. Как приготовить р-в Гриньяра в
лаборатории. Р-вы Гриньяра и р-ция Вюрца.
2.
Реакции р-вов Гриньяра с соединениями, имеющими подвижный
водород. Обратить внимание на амины, амиды, ацетилен и другие сильные
СН-кислоты.
3.
Окислители (неметаллы - О2, S, Hal2) и соли металлов (AgBr, CuCl2, CoCl2).
4.
Галогениды Zn, Hg, Si, P –
общий метод получения элементоорганических соединений.
5.
Реакции р-ва Гриньяра с карбонильными соединениями, сложными
эфирами, перв.- и трет.- амидами, RCOCl, RCºN, СО2, окисью
этилена, пропилена
6.
Какие функциональные группы (ФГ) не могут быть в р-ве
Гриньяра?
Специальные активированные формы магния,
применяемые в особых случаях: тонкодисперсный магний Рике, магний-антраценовый
комплекс.
7. ЛИТИЙОРГАНИЧЕСКИЕ
соединения. Получение из RHal.
Растворитель. Строение. Другие методы синтеза: а) обмен, б) о-литиирование, в) металлирование в прис. ТМЭДА (толуол), г )
литиирование СН3СН2СºСН, СНС13.
8.
Особенности использования Li-органических соединений. Какие ФГ могут быть в ЛОС.
9.
МЕДЬОРГАНИЧЕСКИЕ соединения (купраты). Особенности реакционной
способности. Ряд электрофилов по уменьшению реакционной способности. RCOCl > RCHO> окись этилена и тозилаты > I >> кетонов (кетоны
практически НЕ реагируют!).
10.
Строение купратов
сложное. Механизм – SN2
по кинетике с инверсией. Для Ar
и Vyn галогенидов –
не SN2. Использование: реакции типа Вюрца, 1,4-присоединение
к α,β–непредельным карбонильным соединениям (будет позже).
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ НЕПЕРЕХОДНЫХ И НЕКОТОРЫХ ПЕРЕХОДНЫХ
МЕТАЛЛОВ, а также бора, как РЕАГЕНТЫ
В КУРСЕ ОРГАНИЧЕСКОЙ ХИМИИ
или что должен знать образцово-показательный
студент (ОПС) о химии металлоорганических соединений.
|
Металл или элемент
|
Где (в каких разделах курса) встречается?
Часто ли используется?
|
Для чего?
|
Чуствительность к воздуху и воде
|
|
Li
|
ВЕЗДЕ,
ЧАСТО
|
Введение R к электрофильному центру
|
Горят на воздухе,
очень бурно или даже со взрывом реагируют с водой
|
|
Na
|
Реакция Вюрца
Редко
Примечание: здесь не идёт речь
о енолятях натрия!)
|
История химии
|
В чистом виде ещё более активны, чем Li –органические соединения. В чистом
получают редко, Это трудно.
|
|
Mg
|
ВЕЗДЕ,
ОЧЕНЬ ЧАСТО
|
Введение R к электрофильному центру
|
Окисляются, очень
бурно реагируют с Н2О
|
|
B
|
1)
гидроборирование
2)
кросс-сочетание
3)
присоединение к
α,β–непредельным карбонильным соед.
|
1)
гидрирование,
введение Hal, OH;
2)
введение Ar, винилов в арены, алкены, катализ Pd или Ni
|
Низшие бораны
горят, арилбороновые кислоты ArB(OH)2 – "живут" в воде
|
|
Al
|
Гидроалюминирование алкинов
|
Гидрирование С≡С
|
Очень сильно горят, C-Al
связь расщепляется даже спиртом
|
|
Zn
|
1) Реагент Симмонса-Смита,
2) реакция Реформатского
(реально здесь действуют еноляты цинка!)
|
1) карбеноид, синтез циклопропанов;
2) XZnCH2COOR реагируют похоже на RMgX
|
R2Zn – горят, другие
окисляются, гидролизуются
|
|
Cd
|
Ослабление р-ционной
способности RMgX:
RCOCl
+ RCdCl – нет
присоединения по С=О!
|
Окисляются, гидролизуются
|
|
Hg
|
1) Гидрокси- и
алкоксимеркурирование алкенов и аренов (последнее – редко!)
2) теория реакций SE (факультативно)
|
Стабильны, С-Hg расщепляется кислотами
|
|
Ti
|
1) Катализ стереоселективной полимеризации
2) реакция Кулинковича (1993, синтез циклопропанов).
|
Окисляются, гидролизуются
|
|
Cu
|
1) R2CuLi 2) RC≡CCu
Реакция типа Вюрца,
присоединение к α,β–непредельным карбонильным соед.
|
Окисляются, R2CuLi гидролизуются.
|
|
Fe
|
Ферроцен
|
Типично
ароматическое соединение, "сэндвич", стабилен на воздухе и в воде.
|
СПИРТЫ (1,5 лекции).
1. СПОСОБЫ СИНТЕЗА ОДНОАТОМНЫХ СПИРТОВ.
(методы, которые были
рассмотрены ранее).
- Гидратация алкенов. Только для ЕtOH, i-PrOH, 300oC, 40-70 атм., Н3РО4/SiO2, можно H2SO4
2. Гидроксимеркурирование. Ацетат ртути, ТГФ,
вода, затем восстановление NaBH4 Выходы
90-98%. По правилу Марковникова.
3. Гидроборирование, затем оксиление Н2О2.
Формально – против правила Марковникова.
4. Гидролиз алкилгалогенидов (Нуклеофильное
замещение). Гидролиз производных спиртов (сложных эфиров).
5. Синтезы на основе реактива Гриньяра.
_______________________________________________________
6. Восстановление карбонильных соединений В
СПИРТЫ (новый материал).
LiAlH4
– восст. альдегиды, кетоны, сл. эфиры, карб. к-ты.
AlH3 –
аналогично, но менее удобно и редко.
LiBH4
– восст. альдегиды, кетоны, сл. эфиры,
Это более редкий реагент.
NaBH4 –
восст. альдегиды, кетоны,
NaBH3СN – восст. медленно альдегиды, кетоны.
В2Н6 – восст. медленно альдегиды, кетоны, быстро
– кислоты.
Пространственно затрудненные гидриды (Sia2BH, ДИБАЛ-Н) –
восст. в спирты только альдегиды, кетоны.
Синтез спиртов из эпоксидов при восстановлении LiAlH4
- Промышленные способы синтеза. Метанол
из синтез-газа. Этанол – гидратацией этилена, брожением.
- Реакция
RXcKO2 (DMSO, 18-crown-6)
(факультативно).
2.
СВОЙСТВА СПИРТОВ.
- Кислотность
спиртов (кратко). Много ли алкоголята в растворе NaOHв EtOH?
- Основность
спиртов (очень кратко). Где проявляется?
- Замещение
гидроксильной группы в спиртах на галоген (кратко, поскольку эта тема
подробно рассмотрена на лекциях по нуклеофильному замещению).
- Эфиры
спиртов и неорганических кислот (серной, фосфорной, фосфористой). Реакция
спиртов с галогенидами фосфора. Перегруппировка Арбузова как
последовательность из двух реакций нуклеофильного замещения.
- Дегидратация
спиртов (очень кратко, подробно в теме – Реакции элиминирования, см.
выше).
- Защита
гидроксильной группы в спиртах (DHP, Si-эфиры,
PhCH2- и
Tr).
- ОКИСЛЕНИЕ
СПИРТОВ.
ОСНОВНЫЕ МЕТОДЫ И
РЕАГЕНТЫ, ПРИМЕНЯЕМЫЕ ДЛЯ ОКИСЛЕНИЯ ПЕРВИЧНЫХ И ВТОРИЧНЫХ СПИРТОВ
|
ОКИСЛИТЕЛИ
|
Характерные
реагенты
|
|
Ионы металлов
|
Соединения Сr(VI), KMnO4, MnO2, RuO4, (NH4)2Ce(NO3)6,
K3Fe(CN)6,
Pb(OAc)4,
NiO2
|
|
Галогены
|
Br2, NaOCl, N-бромсукцинимид,
INO3/
пиридин, PhICl2
|
|
ДМСО-электрофил
|
электрофилы – SO3/пиридин,
ДЦГК/H3PO4, оксалилхлорид,
(CF3CO)2O, TsCl, Ac2O
|
|
Р-ция Оппенауэра
|
ацетон
(циклогексанон)-(RO)3Al,
R=t-Bu, i-Pr –
|
|
Каталитическое
дегидрирование
|
газ. фаза – Cu, Ag, Cr,
Ni, ZnOраствор – комплексы Rh, Ru, Os
|
|
Каталитическое
окисление
|
Pt/O2, CuO
|
ДЦГК - С6Н11N=C=NC6H11
3.
ДВУХАТОМНЫЕ СПИРТЫ (ДИОЛЫ).
1.
Методы синтеза
Напоминание: 1,2-диолы можно
получить гидроксилированием алкенов. 1,4-бутандиол можно получить по
Фаворскому-Реппе с последующим гидрированием. 1,n – диолы (или α, ω-диолы) можно получить восстановлением
соответствующих карбонильных соединений (или α, ω-дикарбоновых кислот
или их эфиров).
Восстановительная димеризация
кетонов. (см. также тему – "химия кетонов").
Как провести восстановительную димеризацию альдегидов по Кори? (TiCl4/Zn)
2.
Особенности химических свойств.
а) окислительное расщепление
1,2-диолов периодатом или тетраацетатом свинца.
б) пинакон-пинаколиновая
перегруппировка
в) дегидратация до диенов (нужно
для решения задач).
г) ансасольвокислоты.
д) применение диолов (эфиры,
смолы, ВВ)
ПИНАКОН-ПИНАКОЛИНОВАЯ
ПЕРЕГРУППИРОВКА (примеры иллюстрируют, что однозначных закономерностей
по легкости миграции различных групп НЕТ).
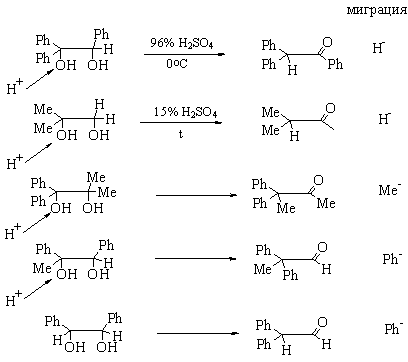
ВАЖНЕЙШИЕ СВЕДЕНИЯ
О ПРОСТЫХ ЭФИРАХ.
СИНТЕЗ.
1)
Межмолекулярная дегидратация спиртов
(только СИММЕТРИЧНЫЕ – Еt2O, Alk2O, диоксан, ТГФ, нельзя t-Bu2O)
2)
Алкоксимеркурирование алкенов (i) Hg(OАc)2 или Hg(OАcF)2,
затем (ii) NaBH4).
3)
Реакция Вильямсона. Имеет ограниченное применение из-за
побочной Е2 реакции, но успешно используется для синтезя ряда интересных
молекул, например, краун-эфиров.
СВОЙСТВА.
1)
Комплексы с кислотами Льюиса, р-римость в сильных кислотах.
2)
Расщепление кислотами – (i) ТОЛЬКО HI
или HBr 120-150oC или (ii) трет-эфиры с любыми сильными кислотами или (iii) BCl3
или BBr3, -20oC/CH2Cl2, затем NaOH.
3)
Расщепление с RLi
– долго, медленно, как побочный процесс, особенно заметно с ТГФ. C RNa расщепление быстрое.
4)
Радикальное окисление, образование перекисей при хранении.
5)
Краун-эфиры и их применение
ОКСИРАНЫ (и,
отчасти, оксетаны) – это не обычные простые эфиры!!!
ТИОЛЫ (RSH) И СУЛЬФИДЫ (RSR).
МИНИМУМ ЗНАНИЙ ДЛЯ
ЭКЗАМЕНА.
1. Запах отвратительный (см. 1-ю лекцию).
2. Н-связи слабые, → т.кип. ниже, чем у соотв. спиртов
ROH.
3. ВАЖНЕЙШИЕ СВОЙСТВА – кислотность, нуклеофильность и окисляемость.
а) RSH
более кислые (рКа 9,5-11), чем спирты,
б) высокая нуклеофильность RSH и аниона RS-, синтез RSR из RS-.
в) высокая нуклеофильность RSR: Me2S
+ MeBr → Me3S+Br–
(триметилсульфоний бромид).
г) ВАЖНЕЙШЕЕ
РАЗЛИЧИЕ В СВОЙСТВАХ ROH и RSH – разное отношение к окислителям. Сравните: ROH→RCHO→RCOOH (образуется термодинамически
выгодная С=О группа) и
RSH→RS-SR, (окислители – I2 или Н2О2)
или RSH→RSО3Н, (сильные
окислители, напр. HNO3,
KMnO4)
или иногда R2S→R2S+–О– (окислители
– NaIO4, t-BuOCl).
4. СИНТЕЗ:
на "3": а) RHal + NaSH , 50-60%, побочно RSR.
на "4": б) гидролиз ксантогенатов RO-C(=S)SR. Делают так: EtONa + CS2, затем RI.
на "5": в) гидролиз тиурониевых
солей, из тиомочевины RBr
+ S=C(NH2)2 → RS-C(NH2)=NH2+Br– → RSH.
КАРБОНИЛЬНЫЕ
СОЕДИНЕНИЯ (5½ лекций).
СПОСОБЫ СИНТЕЗА АЛЬДЕГИДОВ И КЕТОНОВ, ИЗВЕСТНЫЕ ИЗ
ПРЕДЫДУЩИХ ЛЕКЦИЙ.
1.
ОКИСЛЕНИЕ СПИРТОВ.
ДЕГИДРИРОВАНИЕ СПИРТОВ.
2.
ОЗОНОЛИЗ АЛКЕНОВ в
присутствии восстановителей (Zn, Ph3P и др.).
3.
ОКИСЛИТЕЛЬНОЕ РАСЩЕПЛЕНИЕ
ДИОЛОВ (NaIO4,
Pb(OAc)4 ).
4.
ГИДРОБОРИРОВАНИЕ
АЛКИНОВ (с последующим окислением Н2О2) – синтез АЛЬДЕГИДОВ.
5.
СИНТЕЗ С МАГНИЙОРГАНИЧЕСКИМИ
СОЕДИНЕНИЯМИ { использование RC(O)NMe2,
HC(O)NMe2, R-CN, RC(O)Cl, HC(OR)3 }
и КУПРАТАМИ - использование RC(O)Cl.
6. РЕАКЦИЯ КУЧЕРОВА.
7
ПИНАКОЛИНОВАЯ
ПЕРЕГРУППИРОВКА.
8
ВОССТАНОВЛЕНИЕ
КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ.
а) восстановление хлорангидридов
по Роземунду
б) восстановление хлорангидридов
"ослабленным" LiAlH4.
в) использование RCN и RC(O)NH2 для получения альдегидов
г) использование ДИБАЛ-Н
9. Пиролиз солей
карбоновых кислот.
10. Гидролиз гем-дигалогенидов.
СПОСОБЫ СИНТЕЗА АЛЬДЕГИДОВ
И КЕТОНОВ, КОТОРЫЕ БУДУТ ИЗВЕСТНЫ ИЗ ПОСЛЕДУЮЩИХ
ЛЕКЦИЙ.
11. Гидроформилирование
алкенов (тема – реакции, катализируемые комплексами переходных металлов).
12. Вакер-процесс (тема – реакции,
катализируемые комплексами переходных металлов).
13. КОНДЕНСАЦИИ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ.
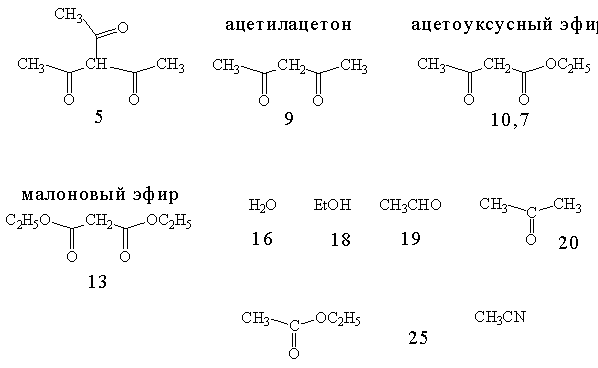
14. СИНТЕЗЫ с АЦЕТОУКСУСНЫМ ЭФИРОМ (АУЭ).
15. 1,4-ПРИСОЕДИНЕНИЕ К a,b-НЕПРЕДЕЛЬНЫМ КАРБОНИЛЬНЫМ
СОЕДИНЕНИЯМ.
16 СПЕЦИАЛЬНЫЕ СПОСОБЫ СИНТЕЗА
АРОМАТИЧЕСКИХ КАРБОНИЛЬНЫХ
СОЕДИНЕНИЙ.
а) окисление α-метильной
группы в метиларенах (CrO3/Ас2О
или CrО2Cl2 – реактив Этара)
Строение и свойства карбонильных
соединений.
1.
Физические свойства альдегидов и сравнение их со спиртами.
2.
Сравнение энергий связи Е(С–С) и Е(С=С), а также Е(С–О) и
Е(С=О).
3.
Особенности строения карбонильной группы. Гибридизация
углерода, реальный заряд на атоме углерода.
4.
Почему и как происходит присоединение нуклеофилов по С=О
группе. МО карбонильной группы. Направление атаки нуклеофила.
Присоединение нуклеофилов к
карбонильной группе.
Различие в реакционной способности между альдегидами и
кетонами. Эффекты заместителей.
1. Обратимость. Положение равновесия определяется относительной
стабильностью исходных и конечных соединений. Пояснить, почему? Механизм
кислотного и основного катализа. Присоединение каких нуклеофилов необратимо?
2. Гидратация карбонильных соединений. В каких случаях
равновесие гидратации сдвинуто в сторону гидратов (гем-диолов)? 2-3- примера.
3. Образование полуацеталей и ацеталей. В какой среде, что
образуется, и что гидролизуется? Механизм писать, не задумываясь. Различия в
поведении альдегидов и кетонов в этой реакции.
Циклические ацетали (кетали). Защита С=О группы и примеры
применения в синтезе.
4. Присоединение NaHSO3. Какой атом – нуклеофил? Почему нужен именно
кислый сульфит? Использование аддуктов.
5. Присоединение HCN. Почему именно основный катализ? Использование циангидринов в
синтезе. Примеры. Присоединение ацетиленов.
6. Присоединение азотистых нуклеофилов. Механизм. В какой
среде? Как зависит скорость от рН? Почему? Имины и енамины. Оксимы, гидразоны.
2,4-ДНФГ. Уротропин.
Реакции иминирования в
живых клетках. Трансаминирование. Зачем нужен витамин В6?
7 1,3-Дитианы. Синтез, особенности катализа при образовании
и разрушении. CH-кислотность.
Реакция с BuLi и
другими сильными основаниями.
Использование анионов в синтезе (р-ция с RHal, RCOCl, оксираном, RCHO). Что такое Umpolung?
1,2- и 1,4-
присоединение дитианов (факультативно).
8. Перегруппировка Бекмана. Механизм. Что такое секстетный
атом азота? Какой R
мигрирует? Применение в промышленности.
9. Синтез илидов фосфора из фосфинов. Реакция Виттига. Схема
и движущая сила реакции. Почему для илидов с электроноакцепторными группами
предпочтительно образование транс-
изомеров? Когда образуются цис- изомеры и
почему (факультативно). Реакция Хорнера на примере фосфоновоуксусного
эфира.
10. Реакция с илидами серы. Почему отличается продукт от реакции Виттига?
11. Реакция С=О с RMgX и RLi.
Побочные процессы – восстановление и енолизация.
12. Восстановление С=О.
Отличие между LiAlH4 и NaBH4. (Комплекс
LiAlH4/AlCl3 и LiBH4 – на 5+,
т.е. для особо продвинутых студентов.
Превращение С=О в СН2.
Восстановление по Кижнеру-Вольфу (модификация Хуан-Минлона, без выделения гидразона),
Клемменсену (в основном для ароматических кетонов), через дитианы.Условия.
Реакции гидридного переноса. Реакция
Меервейна-Понндорфа-Оппенауэра-Верлея.. Модель 6-ти-членного переходного
состояния. Использование в
стереоселективном синтезе.
Реакция Канниццаро. Какие
основания лучше брать? Область применения. Перекрестная реакция Канниццаро.
Какое карбонильное соединение всегда окисляется?
13. Анион-радикальная димеризация альдегидов и кетонов см.
также в теме "Диолы". Механизм. При каком
катализаторе можно использовать для альдегидов (на 5+)?
14. Какие реакции альдегидов не могут идти для кетонов?
(Проанализировать вышеуказанный материал или найти готовый ответ в "зелёном" кафедральном
задачнике, 1971 г.).
РЕАКЦИИ, ПРОТЕКАЮЩИЕ ЧЕРЕЗ ОБРАЗОВАНИЕ ЕНОЛЬНОЙ ФОРМЫ.
1.
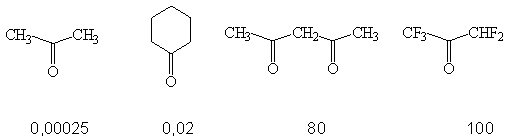
Влияние С=О на кислотность α-С-Н связей в карбонильных
соединениях (КС). Сравнение кислотности КС и спиртов. Дейтерообмен в КС. Почему
практически не проявляется кислотность у СНО группы?
2.
Енолизация, катализируемая кислотами и основаниями. Уметь
грамотно написать.
3. Галогенирование
КС. Кинетическое уравнение.
4. Не путать енол и енолят! Не путать равновесие кето-енольной
таутомерии, и резонансную стабилизацию енолята.
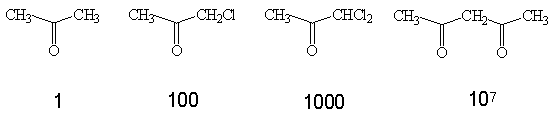
ОТНОСИТЕЛЬНАЯ СКОРОСТЬ ЕНОЛИЗАЦИИ КЕТОНОВ.
(в щелочной среде).
% ЕНОЛА В РАВНОВЕСИИ
КИСЛОТНОСТЬ НЕКОТОРЫХ СОЕДИНЕНИЙ
(рКа).
НАПРАВЛЕНИЕ ЕНОЛИЗАЦИИ
НЕСИММЕТРИЧНЫХ КЕТОНОВ.
КАК ЭТО
ОТРАЖАЕТСЯ НА НАПРАВЛЕНИИ БРОМИРОВАНИЯ?
В равновесных условиях, как и положено по законам
термодинамики, соотношение двух енолов в условиях кислоного и основного
катализа одинаково. Почему же тогда получаются различные продукты, например,
при бромировании в кислой и щелочной среде?
Обе реакции являются кинетически контролируемыми, то есть в
продуктах доминирует тот, который получается с большей скоростью. Рассмотрим
схему реакции в щелочной среде. Енолизация происходит через образование
енолята.
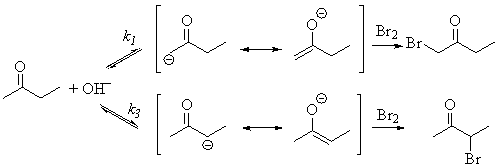
Скорость депротонирования существенно выше для атаки
основания по менее замещенному центру (CH-кислотность выше для менее замещенного атома из-за +I-эффекта алкильных групп, k1 > k3). Скорость
бромирования енолята чрезвычайно велика. В присутсвии бромирующего агента
каждая молекула енолята немедленно превращается в продукт бромирования. До
енола дело не доходит. Поэтому терминальный бромид получается с большей
скоростью. Далее, см. таблицу.
В кислой среде енолизация происходит через протонирование
кислорода.
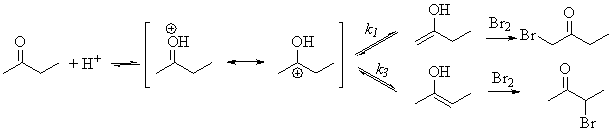
Закономерности этого процесса диктуются относительной
устойчивостью енолов. Более замещенный енол более устойчив (см. относительную
устойчивость алкенов) и образуется с большей скоростью (k3
> k1). И здесь бромирование – очень быстрая реакция.
В присутствии бромирующего агента каждая молекула енола немедленно превращается
в бромпроизводное. Поэтому, более замещенный бромид получается с большей
скоростью и преобладает. Далее, см. таблицу. Подобные закономерности
свойственны не только бромированию, но и всем реакциям, в которых
скоростьопределяющей стадией является образование енолята или енола.
|
Щелочная среда.
|
Кислая среда.
|
|
Соотношение скоростей
монобромирования:
Vположение 1/Vположение
3 = 1,5
Соотношение скоростей
дибромирования:
Vположение 1/Vположение
3 = 900
|
Ацетатный буфер (рН 3-4).
Соотношение скоростей – 1:1
60% серная кислота:
соотношение 3-Br/1-Br = 11 : 1
соотношение 3-Cl/1-Cl = 9 : 1
|
|
ВЫВОД: Бромируется терминальная СН3 до конца,
затем следует образование бромоформа.
|
Результат: Введение галогена понижает основность С=О на
2-3 ед. рКа. Протонирование и дальнейшая енолизация идут хуже. Входит один
атом галогена в положение 3.
|
ГАЛОФОРМНАЯ РЕАКЦИЯ И ЕЁ ИСПОЛЬЗОВАНИЕ В СИНТЕЗЕ.
АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ или какие пункты плана лекции и комментарии
д.б. в хорошем конспекте
1.
Альдольная конденсация пропионового альдегида в щелочной и
кислой среде.
2.
Кротоновая конденсация
3.
Понятие "метиленовой" и "карбонильной" компоненты.
4. Если проходит конденсация двух разных карбонильных
соединений, то в общем случае возможно образование смеси 4 продуктов только на
1-й стадии конденсации (т.е. на стадии АК).
Существует правило,
что более активное карбонильное соед. (т.е. соед. с более акт. С=О группой),
более охотно будет играть роль карбонильной компоненты. Предельный случай –
СН2=О. Это самое активное карбонильное соединение, не имеющее
метиленовой группы –это всегда только карбонильная компонента.
Это правило
соблюдается даже при перекрестной конденсации уксусного и пропионового
альдегидов. (Какое соединение из них имеет несколько большую карбонильную
активность?). При кротоновой конденсации их смеси можно получить (после
трехкратной перегонки) 35% тиглинового альдегида МеСН=С(Ме) – СНО. (По
статистике здесь выход д.б. не более 25%, а с потерями – еще меньше.) Однако
такие "дедовские методы" сейчас практически не применяются.
Более распространенным является случай, когда одно из карбонильных соединений НЕ МОЖЕТ БЫТЬ метиленовой
компонентой. Это конденсации с СН2=О, Ar-CHO, CCl3CHO, t-Bu-CHO.
Три первых соединения имеют довольно активную С=О группу, последнее соединение
– малоактивную С=О группу. Его лучше не брать как КК. Обратите внимание, что
хлораль не следует использовать в конденсация в щел. среде (а почему?).
5. Какие конкретные условия "классических" А-К конденсаций
должен знать студент (при ответе на 4-5 баллов)? Уравнения – на доске, или
вписать самостоятельно.
1)
PrCHO
(NaOH, вода, 0оC) → продукт АК: Pr-CH(OH)-CH(Et)-CHO
75%.
2)
PrCHO
(EtONa, 100оC) → продукт кротоновой
конденсации.
3)
PrCHO
(Н+, нагрев.) → продукт кротоновой конденсации.
Т.е. кислая среда и нагревание способствуют элиминированию воды
(продукт КК).
Еще несколько хрестоматийных примеров.
СН3СОСН3 + СН2О в щел среде → трудно остановить на
стадии СН3СОСН2СН2ОН или СН3СОСН=СН2.
Легко получается (НОСН2)3СС(О)С(СН2ОН)3
Синтез пентаэритрита –
вопрос на 4: МеСНО + 3 СН2=О [Са(ОН)2]→ (НОСН2)3С–СНО,
далее еще моль СН2=О для
перекрестной реакции Канниццаро, получают С(СН2ОН)4
Синтез диацетонового спирта в аппарате Сокслета.
СИНТЕЗ ОКИСИ МЕЗИТИЛА
(чрезвычайно часто используется в
контрольных работах!) Ме2С=СН–С(О)–Ме.
1)
Чисто с хорошим выходом можно получить из диацетонового спирта
при кислотно-катализируемой дегидратации при нагревании. 2) Конденсация ацетона
Н-катионитах при нагревании. 3) При конденсации ацетона в кислой среде выход
очень умеренный, т.к. побочно образуется форон и мезитилен. Однако студенту 3
курса разрешается указать такие
условия: ацетон, Н+ → →окись мезитила.
Синтез халконов из бензальдегида и кетонов. Трудно
остановить р-цию на стадии АК!
ОЧЕНЬ ВАЖНО ДЛЯ РЕШЕНЯ ЗАДАЧ – уметь распознать из каких фрагментов
сделан продукт кротоновой или
альдольной конденсации. Разрезать по С=С, приписать к одному из С два Н, а к
другому - =О. Для продукта АК – провести ретросинтез.
НАПРАВЛЕННАЯ АК.
Чтобы генерировать чистый енолят из карбонильного
соединения, используемое основание должно быть на 5 и более единиц pK более сильным чем
образующийся енолят (то есть pK(основание)
>> pK(карбонильное
соединение). Если основности сравнимы, то енолят в системе будет сосуществовать
с исходным карбонильным соединением, что неминуемо приведет к самоконденсации.
Даже при использовании очень сильных оснований, депротонирование ведут при
низкой температуре, чтобы дополнительно подавить самоконденсацию.
Ацетон + EtONa→ только
0,01% енолята в равновесии, что приводит к быстрой самоконденсации.
Ацетон + LDA,
-78оС, ТГФ (или подобные металлирующие агенты, например NaNH2, KH,
(Me3Si)2NNa, но не BuLi!) → 100% енолята (при обратном порядке прибавления – кетон добавляют в
охлажденный раствор или суспензию основания).
ГЛАВНАЯ ИДЕЯ НАПРАВЛЕННОЙ
АК – получить заранее 100% енолята и использовать его, как метиленовую
компоненту в АК.
Не будет смеси 4
продуктов! Выходы целевых продуктов очень высокие!
Присоединение енолята идет быстрее, чем переметаллирование!
Нет элиминирования с образованием продукта кротоновой
конденсации.
Можно проводить направленную АК для системы кетон + кетон.
Для получение енолята из кетона следует брать симм. кетон.
Если брать несимм. кетон – то он должен енолизоваться однозначно.
Можно было бы сделать енолят из альдегида, тогда он
становится метиленовой компонентой в
конденсации с кетоном (такая комбинация
невозможна в "классическом" варианте АК!).
НО ЕСТЬ ПРОБЛЕМА:
Еноляты из альдегидов легко конденсируются со своим же исходным альдегидом даже
при -78оС. НЕЖЕЛАТЕЛЬНО ДЕЛАТЬ ЕНОЛЯТЫ ИЗ АЛЬДЕГИДОВ ДЛЯ НАПРАВЛЕННОЙ
АК!
Как решить проблему? Сделать
из альдегида основание Шиффа, например с MeNH2. Из него с LDA при -78С, ТГФ сделать
Li- производное –
азотистый аналог Li-енолята
СH2=CH – NLiMe. Оно менее реакционноспособно и не
вступает в конденсацию с исходных имином. Далее его вводят в конденсацию с КС
(например, с кетоном), гидролизуют иминогруппу в Н+, → получают продукт
направленной АК.
КАКИЕ ЕЩЕ эквиваленты
енолятов существуют?
Si- или B- эфиры
енолов, Например: СН2=СН-О-SiMe3 или СН2=СН-О-BEt2
Si- или В- эфиры енолов легко получить
из RСНО + Me3SiCl или R2BOTf в присутствии основания, например, триэтиламина.
Для конденсации с силиловым эфиром НУЖЕН ОБЯЗАТЕЛЬНО КАТАЛИЗАТОР – кислота Льюиса
(например, TiCl4, ZnCl2, CeCl3). Данный
вариант кислотно-катализируемой направленной альдольной конденсации (альдольная
реакция Мукаямы) чрезвычайно популярен в современном органическом синтезе.
СИЛИЛОВЫЕ ЭФИРЫ
ЕНОЛОВ можно алкилировать (в присутствии TiCl4!!!)
по атому С не только алкилгалогенидами, активными в SN2 реакциях, но и такими,
как t-BuCl (активен только в SN1!) или неопентилхлорид
(малоактивен в SN2
и SN1)
Примеры.
ЕНАМИНЫ и их
использование в синтезе (знать всем!).
Енамины – сильные нуклеофилы. Почему? Это – аналоги енолятов
по реакционной способности. Пояснить с помощью предельных (резонансных
структур. Их можно алкилировать по С алкилгалогенидами, но не всеми! Условия
алкилирования – МеСN
или диоксан, кипячение10-20 ч. Хорошо для аллил-, бензилгалогенидов, ацилхлоридов,
α-хлоркетонов. Плохо для МеI:
побочно кватернизация (алкилирование) по атому азота. Но использование подобных
RHal не является грубой
ошибкой, т.к. иногда возможно. Енамины можно использовать в присоединении по
Михаэлю в качестве аналога енолята (см. ниже).
ТАБЛИЦА, СПЕЦИФИЧЕСКИЕ ЭКВИВАЛЕНТЫ ЕНОЛОВ ДЛЯ АЛЬДЕГИДОВ И
КЕТОНОВ.
Еноляты лития.
Могут быть использованы с SN2
нуклеофилами, но не могут быть сделаны из альдегидов.
Аза-еноляты лития
альдегидов и кетонов могут быть использованы с теми же SN2 электрофилами, но МОГУТ
быть сделаны из альдегидов.
Енамины альдегидов
и кетонов могут быть использованы в реакциях с аллильными, бензильными
или a-галогенкарбонильными
соединениями, а также с галогенангидридами карбоновых кислот.
Силиловые еноловые
эфиры могут быть использованы (в присутствии TiCl4) cSN1
алкилгалогенидами (аллил, бензил, трет-алкил).
НАПРАВЛЕНИЕ
ЕНОЛИЗАЦИИ НЕСИММЕТРИЧНЫХ КЕТОНОВ.
(напр. под действием LDA): см. Реутов, Курц, Бутин, т.3, с. 107 табл. 17-4. Из этой
табл достаточно иметь представление об одном примере, например
2-метилциклопентанон. При кинетическом контроле (-78оС) образуется
72% менее замещённого енолятя и 28% более замещённого. При ТМД контроле только
6% менее замещённого и 94% - более
замещенного енолята. Как это определяли? – Действовали Me3SiCl при низкой т-ре и смотрели соотношение силилированных
продуктов по ПМР.
В каких условиях образуются кинетически и термодинамически
контролируемые продукты енолизации?
Что влияет на кинетический и
термодинамический контроль
при образование енолятов
несимметричных кетонов (на 5+)
Кинетика: 1) апротонные
растворители (напр. ГМФТА и т.п.)
2) сильные основания – слабые нуклеофилы (напр. LDA и т.п.)
3) Li+ лучше, чем Na+, K+ (более
ковалентная связь, медленнее переход обратно в енол )
4) низкая температура
5) короткое время реакции.
Термодинамика: 1) протонные
растворители (избыток кетона!)
2) нуклеофильные основания
3) Более ионная связь Cat-O
4) более высокая температура
5) длительное время реакции.
Еноляты как амбидентные анионы.
Таблица 17.3 из учебника Реутов, Курц, Бутин (РКБ). Обсуждаются только еноляты монокарбонильных
соединений.
Принцип ЖМКО.
Поляризуемость катионов, как мера их деления на Ж и М.
Ж.катионы – Al3+>Mg2+>Na+. М.катионы: Ag+> Cd2+>Au3+> Sn4+. Катионы Ж – сродство больше к F>O>N>Cl>I>S. Катионы М:
сродство S>I>Br>Cl>N>O>F .
Наиболее прочные
соединения Ж+Ж или М+М.
Жесткие кислоты – малая
поляризуемость, высокая ЭО, малый радиус, Ж растет с зарядом, высокая Е
свободных орбиталей.
Мягкие кислоты – Большая
поляризуемость, малая ЭО, большой R, М растет с уменьшением
заряда. Низкая энергия орбиталей.
Для использования
теории ЖМКО при анализе реакционной способности делается допущение о том что
свойства электрофилов аналогичны свойствам кислот, а свойства нуклеофилов - свойствам оснований. Поэтому можно
говорить о жестких и мягких электрофилах и нуклеофилах, и пользоваться
правилом, что жесткие электрофилы предпочитают реагировать с жесткими нуклеофилами,
а мягкие Э – с мягкими Н. Эти тенденции очень приблизительны и часто не
соблюдаются, но позволяют сделать ряд
полезных обобщений, особенно в реакциях нуклеофильного замещения и
элиминирования.
Алкилирование
и ацилирование енолятов β-дикарбонильных соединений. Влияние природы RX. 1. Природа R: галогениды метил, аллил-,
бензил-, BrCH2COOR –
мягкие.
ROCH2Cl, R2NCH2Cl, RCOCl
– жесткие.
2
Природа Х - OTs, OTf более
жесткие, чем иодиды и бромиды.
3
Растворители. Там,
где ассоциация, агломераты, в Н-растворителях, спиртах – больше С. Там, где
ионные пары, в ДМФ, ДМСО, ГМФТ, в присутствии краунов – больше О.
4. Природа енолята. Еноляты кетонов – алкилирование
С+О. Енолят этилацетата – только С, даже с RCOCl. Енолят
малонового эфира – только С
5. Природа противоиона. От Cs к Li уменьшается количество О и возрастает
С.
Реакция Манниха. Аминометилирование
(введение СН2NR2
группы в α положение к С=О группе.
Реакция аналогична альдольной конденсации. Катион иминия – СН2=NR2+ –
азотистый аналог СН2О. Получаются β-аминометилкетоны. При
нагревании они могут элиминировать втор-амин, еще лучше, если предварительно
для этого кватернизовать азот с MeI.
При элиминировании образуется α,β-непредельный кетон – формально продукт
кротоновой конденсации с СН2=О.
СН2=О + R2NH
+ CH2(COOR)2 – нет
Манниха – есть Реакция Кневенагеля. Катализатор – пиперидин или ацетат аммония, Можно TiCl4/пиридин.
Вариант Кневенагеля-Дебнера для самой малоновой кислоты, а не малонового эфира
– с самопроизвольным декарбоксилированием.
Реакция Перкина.
Синтез коричных кислот. Нельзя алифатические альдегиды. Механизм знать только в
общих чертах – не так подробно, как в учебнике РКБ.
Нитрозирование. Электрофильное присоединение
нитрозоний-катиона к енольной форме.
Формально это можно рассматривать как окисление α-положения кетона.
(процесс идет в кислой среде, направление реакции определяется термодинамикой,
а следовательно в случае несимметричного кетона образуется в основном более
замещенное нитрозопроизводное). Нитрозопроизводные в присутствии кислот легко
превращаются в более устойчивый таутомер – оксим. После гидролиза оксима можно
получить дикетон.
БЕНЗОИНОВАЯ
КОНДЕНСАЦИЯ Образование a-гидроксикетонов (бензоинов), содержащих группировку
–СН(ОН)СО- из двух молекул альдегидов 2RCHO – RCH(OH)COR. Классический
катализатор для Б.к. – цианиды натрия или калия в спиртовой среде. Характерна
для ароматич., некоторых гетероциклич. альдегидов (напр. для фурфурола), а
также альдегидов, не содержащих a-атомов водорода. Для смеси альдегидов возможно
образование несимметричных бензоинов, при этом карбонильная группа продукта
располагается у кольца, имеющего более электронодонорные заместители. Мех-м
надо бы знать. Почему именно цианид-ион является катализатором для бензоиновой
конденсации, а другие нуклеофилы, например, ОН– и RO– не катализируют этот процесс?
Применение в качестве
катализаторов четвертичных тиазолиевых солей (в частности, витамина B1) позволяет существенно расширить область реакции и
получать ацилоины и из алифатических альдегидов. Так в Природе работают
специальные ферменты – транскетолазы.
Бензиловая
перегруппировка. Внутримолекулярная перегруппировка ароматических
1,2-дикетонов в α-гидроксикислоты под действием щелочей или алкоголятов,
при этом из бензила (бензил – тривиальное название дибензоила PhCOCOPh) образуется бензиловая (или
дифенилгликолевая к-та) Ph2C(OH)-COOH. Механизм бензиловой перегруппировки не имеет ничего общего
с бензоиновой конденсацией.
МЕТОДЫ СИНТЕЗА
α,β-НЕПРЕДЕЛЬНЫХ АЛЬДЕГИДОВ И КЕТОНОВ. (Не забыть про окись
мезитила.)
1.
Кротоновая конденсация
2.
α-галогенкетон + мягкое основание (напр. триэтиламин,
пиридин, коллидин, но ни в коем случае не сильные основания, которые вызовут
самоконденсацию, то есть осмоление? или иные побочные реакции). Из
несимметричных кетонов получается более замещенный енон.
3.
Синтез из енолятов и PhSeCl, потом окисление с Н2О2 с
самопроизвольным элиминированием PhSe(OH).
Из несимметричных кетонов получается менее замещенный енон.
Плохо элиминировать HHal из α-галогенкетона щелочью – может пойти пер-ка Фаворского. Простой пример – 2-хлорциклогексанон. Механизм - только на 5+.
1,2- и
1,4-присоединение к α,β–непредельным карбонильным соединениям.
Внимание: в данном
разделе рассматриваются не только непредельные альдегиды и кетоны, но и другие
олефины с –М-заместителем у двойной связи (непредельные кислоты, амиды,
нитрилы, сложные эфиры, и. т.п. Все
такие соединения способны реагировать с нуклеофилами по b-углеродному атому. такие реакции обобщенно называют
1,4-присоединением или присоединением по Михаэлю, а олефины такого типа –
акцепторами Михаэля. Закономерности этих реакций в первом приближении
одинаковы.
Почему
α,β-непредельные КС способны реагировать как 1,2-, так и 1,4-?
Что такое винилогия?
Как разные нуклеофилы
реагируют с α,β-непредельными
КС?
- Амины
→ 1,4 присоединение.
- НСN→
1,2- для альдегидов, для кетонов 1,2- и 1,4- – конкуренция.
Et2AlCN дает
только 1,4 при -20оС в толуоле, потом гидролиз. Это – на 5+.
- RLi – в основном 1,2.
Выходы хорошие
- R2CuLi –
только 1,4- Выходы хорошие
- RMgX – конкуренция 1,2 и
1,4, в зависимости от пространственных препятствий у С=О. Препаративной
ценности уже не представляет.
- R3Bэто
условно Rδ–
–B δ+R2 →
1,4 присоединение (R
на углерод, BR2
на кислород – образуются борные еноляты, которые можно использовать,
напрмер, в альдольной конденсации)
- Перехват
карбаниона PhC–(CN)(OH) в условиях бензоиновой
конденсации. Синтез 1,4-дикетонов
- Еноляты.
Обычно 1,4, см. также аннелирование по Робинсону.
- Li- производные 1,3-дитианов (было раньше). Конкуренция 1,2-
и 1,4- в зависимости от природы растворителя. Добавки CuI приводят к
Сопряженное
присоединение енолятов и енаминов как С- алкилирование. Примеры.
Аннелирование по
Робинсону. Примеры.
Что
влияет на конкуренцию 1,2- (кинетический контроль) и
1,4-
(термодинамический контроль) присоединения к α,β–непредельным
карбонильным соединениям.
1,2- (С=О):
1) низкая
температура, быстро
2) высокая реакционная способность С=О (альдегид)
3) затруднения у β-С
4) жесткие
нуклеофилы
5) RLi,RMgX.
1,4- (C=C):
1) температура
высокая, долго
2) малая реакционная способность С=О (амид)
3) нет затруднения у β-С
4) мягкие нуклеофилы
5) R2CuLi.
ОКИСЛЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ.
АЛЬДЕГИДЫ
- Реагент Джонса (CrO3/H2SO4, 0+20oC) RCHO → RCOOH (>80%).
- KMnO4 (pH 6-10, 0+20oC) RCHO → RCOOH
(>80%).
- Реактив Толленса (Ag2O/NH4OH) RCHO → RCOOH (>80%), не
затрагивает С=С связи и спиртовые группы!
- Аутоокисление альдегидов воздухом при
хранении – но это нельзя использовать в препаративных целях, так как
никогда не бывает полного превращения..
КЕТОНЫ Не окисляются в условиях 1-4.
- KMnO4/NaOH или HNO3 конц. при нагревании. Образование в общем
случае смеси 4 карбоновых к-т (правило Попова, 1872 г.).Считается,
что идет через енольную форму, легче всего расщепляется связь С(О)-Стрет
Связь С(О)-Счетв. не расщепляется.
- Байер-Виллигер. RC(O)R’ → RCOOR’. Реагент –
надкислоты (m-CPBA или R”C(O)OOH, R”= Ph, Me, CF3).
Ряд мигрирующей способности R’: H>Ph>t-Bu>>i-Pr>RCH2>>Me.
Р-ция хороша для симметричных
кетонов или циклов.
Механизм: нуклеофильное
присоединение надкислоты (нуклеофильный центр – дальний кислород пероксидной
группы) к карбонилу, согласованный уход карбоновой кислоты с секстетной
перегруппировкой на оксениевый ион:
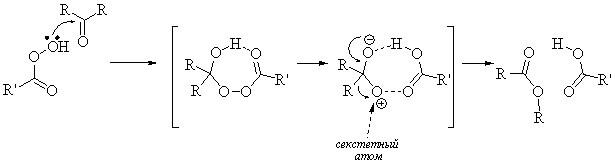
- Окисление α–СН2 группы
с SeO2, напр.: PhC(O)CH3 → енол →енолэфир селенистой к-ты → миграция кислотного
остатка от О к С → (PhC(O)CH2-Se-OH) → PhC(O)CHO +Se + H2O. Механизм – только на
5+.
СЛОЖНОЭФИРНАЯ
КОНДЕНСАЦИЯ (СЭК, 2 лекции).
1.
Конденсация этилового эфира уксусной кислоты под действием
сухого этилата натрия. Механизм. Стехиометрия. Конденсация изомасляного эфира.
Более сильные конденсирующие реагенты.
2.
Конденсация двух различных сложных эфиров. Эфиры, не имеющие
α-С-Н связей (только карбонильные компоненты): бензоаты, формиаты,
оксалаты, карбонаты, пивалаты, трифторацетаты. Направленная сложноэфирная
конденсация – аналогия с направленной альдольной конденсацией.
3.
Конденсация Дикмана.
4.
Конденсация сложного эфира и кетона. Что является карбонильной
компонентой и почему? Синтез ацетилацетона.
5. Конденсация Дарзана.
6.
Реакция Реформатского.
7.
Свойства ацетоуксусного эфира (АУЭ). Таутомерия. Наблюдение.
Влияние растворителей на положение равновесия. Реакции кетонной и енольной
формы.
8.
Синтезы с использованием АУЭ. Кетонное и кислотное расщепление
АУЭ. Примеры С и О алкилирования и ацилирования енолята АУЭ. Дианион АУЭ и его
раздельное алкилирование.
9.
Синтезы с использованием малонового эфира. Синтез α,
ω-дикарбоновых кислот.
10.Примеры синтезов с
использованием СЭК: несколько способов синтеза фенилмалоновой кислоты; синтезы
1,2- 1,3- и 1,4-циклогександионов; синтез N-метилпиперидона-4.
КАРБОНОВЫЕ
КИСЛОТЫ и их производные (3 лекции).
СПОСОБЫ СИНТЕЗА КАРБОН. КИСЛОТ.
1) ОКИСЛЕНИЕROH, RCHO, R-CH=CH2, R-CºCH.
2) ОКИСЛЕНИЕ алкилароматич.
соед. (α-С)
3) ГИДРОЛИЗ R-CºN (Н+
или ОН-, очень жесткие условия)
4) RMgX
или RLi + CO2
5) СИНТЕЗЫ С
МАЛОНОВЫМ ЭФИРОМ.
6) ПРОМЫШЛ. спос.
синтеза. (НСООН, АсОН)
7) Галоформная реакция
8) Р-ция Канниццаро
9) Р-ция Байера-Виллигера для нециклических кетонов (через
сложные эфиры)
СПОСОБЫ СИНТЕЗА КИСЛОТ,
КОТОРЫЕ БУДУТ ИЗВЕСТНЫ ИЗ ПОСЛЕДУЮЩИХ ЛЕКЦИЙ.
10) Гидролиз производных (хлорангидридов, ангидридов, эфиров,
амидов).
11) Метод Арндта-Эйстерта.
12). СИНТЕЗЫ с АЦЕТОУКСУСНЫМ
ЭФИРОМ (АУЭ).
ВАЖНЕЙШИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ.
1) кислотность 2) замещение ОН,
синтез производных 3) восстановление
4) декарбоксилирование: а)
термическое, б) по Кольбе, в) реакция
Бородина-Хунсдиккера, г) пиролитическая кетонизация (тема – " карбонильные
соединения).
5) реакции по α-С-атому (Гелль-Фольгард-Зелинский). Радикальное
галогенирование кислот.
Данные по кислотности карбоновых кислот.pK
AcOH (4.8), HCOOH (3.8), ClCH2COOH (2.8), Cl2CHCOOH (1.3), CCl3COOHи CF3COOHприближаются
к сильным кислотам (pK 0.7 и 0.5 в
воде).
RCH2COOH, где R = MeO (3.6), CN(2.5), PhCH2 (4.3).
CH2=CHCOOH (4.3).
α-,
β-, и
γ-хлормасляные (соотношение констант кислотности 140:9:3).
Производные
карбоновых кислот (КК).
Галогенангидриды
КК. Синтез ХА из кислот – как пример реакций замещения ОН группы
карбоновых кислот. Механизм нуклеофильного замещения при sp2-углеродном атоме в С=О
группе с разрывом связи С(О)-ОН. Создание хорошей УГ или протонирование С=О?
Синтез с помощью PCl3,
PCl5, SOCl2,
хлорангидридов карбоновых кислот (напр. оксалилхлорида).
Взаимодействие с нуклеофильными реагентами и использование
галогенангидридов в синтезе других производных КК. Восстановление ГКК, реакции
с металлоорганическими соединениями.
Метод удлинения углеродной цепи по Арндту-Эйстерту.
Механизм.
Синтез других
пр-ных карбоновых кислот, не обязательно из кислот.
1. Ангидриды. Синтез. 3 группы методов синтеза
и 8 примеров реакций.
2
Кетены как "внутренние" ангидриды карбоновых кислот. Синтез –
3 способа.
3.
Синтез сложных эфиров: 7-8 способов.
СВОЙСТВА ПРОИЗВОДНЫХ
КАРБОНОВЫХ КИСЛОТ. АЦИЛИРОВАНИЕ.
Ряд ацилирующих реагентов, по убыванию
электрофильности.
Свойства ангидридов, кетенов (в основном ацилирование).
Свойства сложных эфиров. Гидролиз – 2 важнейших механизма
(на 3 балла) и два второстепенных (на 5 или 5+).
Синтез амидов – 1) ацилирование NH3 и аминов с RCOX – т.е. с более сильными
ацилирующими реагентами, чем амиды, и даже солями! (примеры). 2) Образование
циклич. имидов (сукцин- и фталимид, их использование). 3) Частичный гидролиз
нитрилов в щелочной среде с 10-15% Н2О2. 4) Что такое
лактамы?
Гидролиз амидов (жесткие условия, сильно кислая или щелочная
среда, знать механизм!).
Восстановление амидов: LiAlH4 – до
аминов. Слабые восстанавливающие. агенты –LiAlH(OEt)3
или ДИБАЛ-Н – до альдегидов. Реакция RMgXc перв. или трет.-амидами.
Реакция RMgX с ДМФ. Что получится? Дегидратация
амидов с SOCl2 в ДМФ.
Секстетные перегруппировки – Гофмана, Курциуса, (Шмидта – на
5+), механизм, нитрены. Можно ли использ. для амидов ароматических или пространственно
затруднённых. кислот? Как выделить изоцианаты? Секстетные перегруппировки ведут
к укорочению цепи
Нитрилы. Синтез. 1) Амбидентная природа СN– аниона. Когда
получаются изонитрилы? 2) синтез из амидов. Свойства. 1) гидролиз (в
какой среде? Легко или нет?) 2) кислотность α-СН. Конденсация Торпа-Циглера (аналогичная Дикману) – будет в теме
"Циклоалканы" 3) Алкоголиз нитрилов. Имидаты, амидины, ДБН и ДБУ - тоже амидины. 4) Восстановление нитрилов (когда в
амины, а когда в альдегиды?). 5) реакция
Риттера (трет- амины.)
Изонитрилы – понятие, синтез из цианидов и
дихлоркарбена. Св-ва. Аналогия с СО, р-ции с галогенами, серой, водой (формамиды),
аминами (амидины). Реакция с RLi .
Непредельные к-ты. Синтез – Кневенагель, Виттиг, Перкин, Хек,
из β-оксикислот. Св-ва, особенности свойств в зависимости от положения
С=С: 1) Присоединение НВг, нуклеофилов, 2) миграция С=С 3) образование лактонов (аллилуксусная к-та).
Жирные кислоты. Образование в организме – из ацетил-КоА
в малонил-КоА и т.д. Особенности жирных кислотв
организме – прямая цепь, четное число атомов С, нет сопряжения С=С, Z-конфигурация С=С. С12- лауриновая, С16-пальмитиновая,
С18- стеариновая.
Непредельные жирные кислоты – С18, D9
– олеиновая, D9,12 –
линолевая, D9,12,15 –
линоленовая (на 5), С20 D5,8,
11,14 – арахидоновая (на 5+). Все цис! Последние три – незаменимые. Из
них образуются простагландины.
Двухосновные к-ты. Тривиальные названия и способы синтеза
С2, С3, С4, С6 дикарбоновых кислот, поведение при нагревании. Диэтилоксалат в
синтезе. Малоновый эфир в синтезе, в реакции Михаэля и Кневенагеля. Янтарная
кислота, её ангидрид, имид, N-бромсукцинимид.
Адипиновая кислота. Конденсация Дикмана. Ацилоиновая конденсация эфиров
дикарбоновых кислот как метод синтеза средних и макроциклов. Фталевая и терефталевая кислоты, получение в
промышленности. Фталимид и его использование в синтезе. Фумаровая и малеиновая
кислоты, их эфиры и использование в синтезе (все это уже было раньше).
Оксикислоты.
1. синтез α-оксикислот –
1) гидролиз
α-галогенкарбоновых кислот
2) циангидринный синтез.
3) контролируемое окисление
гликоля с НNO3 или др. окислителями
2. Синтез
β-оксикислот
1) оксиление
альдолей,
2) восстан β-кетокислот,
3) Реформатский
4) присоединение воды к
α,β непредельным.
3. Синтез γ-оксикислот
1) Восстановление
янтарного ангидрида, гидролиз γ-лактонов
3. Свойства оксикислот. Как избирательно
провести р-ции по ОН или СООН группам? (Реагенты - Na, NaOH, NH3, HBr, PCl5, EtOH,
Ac2O).
Поведение
α,β,γ – оксикислот при нагревании.
Простагландины – биологически активные липиды, производные
гипотетической простановой кислоты (С20 = цепь С7–кольцо циклопентЕНон – цепь С8, 15-ОН), содержащие
циклопентановое кольцо, С=С связи, гидрокси- и оксо- группы. Роль простагландинов, действие аспирина.
УГОЛЬНАЯ КИСЛОТА как
простейшая оксикислота и её производные.
(В этом разделе важно знать
не то, как синтезируют разные нетривиальные производные угольной кислоты
(например гуанидин, карбодиимид, тиомочевина), а то как эти соединения
используют в химическом синтезе.)
Фосген, формула,
токсичность, свойства, реакция с водой, спиртами.
Хлоругольный и
хлормуравьиный эфир – одно и то же. Формула. Как сделать.
Эфиры угольной
кислоты - карбонаты. Получение
Дифосген и трифосген – знать НЕ ОБЯЗАТЕЛЬНО. (Дифосген –
полностью хлорированный хлоругольный эфир. Похож на фосген и при пиролизе они
дают фосген.)
С(OR)4
– ортоугольный эфир. Делать можно из СС14, но лучше из хлорпикрина
(на 5+) и RONa.
Сероуглерод, реакция
с RONa, ксантогенаты – знать обязательно.
Мочевина. Ее синтез из СаС2 и азота при
сильном нагревании – через цианамид кальция и его гидролиз – Са-NCN - исторически один из первых способов фиксации азота.
Мочевина + НNO2
- тема 2-го семестра. Конденсация
малоновой кислоты и мочевины – типичная задача для контрольной. Знать на 5+.
Получается барбитуровая кислота – ее пр-ные – известные снотворные (веронал,
фенобарбитал и др.)
Тиомочевина –
алкилирование RI по
атому серы – изотиурониевые соли – промежуточные в-вы при синтезе меркаптанов –
на 5+.
Карбаминовая к-та -
полуамид угольной к-ты. Карбамат
аммония – белый налет на стеклах вытяжных шкафов в комнатах, где хранятся
амины.
Гуанидин. Знать
формулу. Получение – не обязательно. Получают (i) – из гуано. (ii) из ортоугольного эфира и аммиака,
если очень хочется. ОДНО ИЗ САМЫХ СИЛЬНЫХ органических оснований – почему?
Сравнить с близкими по структуре амидинами, аминами, амидами.
Семикарбазид –
был в теме карбонильные соединения. Для чего его там используют?
Карбодиимды. R-N=C=N-R. Формула. Применение формально –
это водоотнимающее средство. При реакции с карбоновыми кислотами образует производные, похожие по
реакционной способности на ангидриды. Эти производные без выделения используют
в реакциях со спиртами и аминами с образованием сложных эфиров и амидов в
мягких условиях, например, в пептидном синтезе. Напишите уравнение один раз
самостоятельно. Что получится. Получение – не обязательно (из
дициклогексилтиомочевины и HgO)
R-N=C=O. Это тоже пр-ные угольной
к-ты. Где они встречались? Как их
делают (по программе)? Как они реагируют со спиртами, аминами. Какое
рапределение зарядов. Аналогия с СО2. Изотиоцианаты – на 5+, делают
из R-N=C + S
(простой способ для экзамена, не обязательный).
Не обязательно знать что такое цианаты, тиоцианаты, фульминаты
(гремучая ртуть) все это изомеры изоцианатов, изотиоцианатов и др.)
СОСТАВ ЖИРОВ РЫБ,
РАСТЕНИЙ и ЖИВОТНЫХ, в %.
|
ЖИР
|
Насыщ. Ж.К.
|
Ненасыщенные жирные кислоты
|
|
|
|
олеиновая
|
линолевая
|
линоленовая
|
арахидоновая.
|
|
Оливковый
|
10
|
54-81
|
15
|
-
|
|
|
Льняной
|
10
|
13-29
|
15-30
|
44
|
|
|
Пальмовый
|
50
|
32-37
|
5-15
|
-
|
|
|
Какао бобы
|
60-62
|
36-38
|
2
|
-
|
|
|
Трески
|
24
|
29-31
|
2
|
2
|
1-3
|
|
Свиной
|
36
|
38-42
|
8-9
|
2
|
2
|
|
Бараний
|
60
|
32-35
|
3-4
|
-
|
|
|
Говяжий
|
60-68
|
28-36
|
4-5
|
-
|
|
|
Теперь
понятно, почему некоторые очень любят сало и оно даже м.б. полезным?
|
Какао-бобы состоят из жиров , 12— 15 %
белковых веществ, 6—10 % углеводов. Масло-какао имеет твердую консистенцию, а
плавится оно при относительно низкой температуре, близкой к температуре
человеческого тела. Поэтому шоколадная плитка тверда, но она приятно тает во
рту. Состав жиров какао – более 70 %
олео-пальмито-стеарина и олео-дистеарина. В шоколаде обычно содержится около
0,4% теобромина, 0,05—0,1 % кофеина, красный какао-пигмент, Приятное
благоухание обеспечивают по меньшей мере 40 летучих соединений, среди них –
изоамилциннамат, линалоол, амилацетат, амилбутират, бутилацетат.
Н.В.Лукашёв, А.В.Чепраков
| 
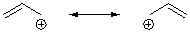

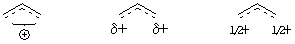
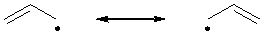 или
или  .
.