Тема: Анализ смесей, разделение продуктов реакций, установление строения органических веществ
Цель работы. Целью работы является знакомство с основополагающими понятиями и возможностями спектроскопии ЯМР 13С и определение строения неизвестного органического соединения (на примере производных адамантана) на основе анализа его обзорного спектра и отнесения сигналов ядер 13С с использованием аддитивных закономерностей в поведении химических сдвигов углеродов.
Введение. Ядерный магнитный резонанс (ЯМР), введенный в химическую практику в 1950 году, в настоящее время стал одним из наиболее распространенных и эффективных методов решения химических проблем. Исключительная роль спектроскопии ЯМР в химических исследованиях определяется тем, что она оказывается полезным, а часто незаменимым источником информации на всех стадиях исследования - от изучения состава реакционных смесей до установления строения и динамических характеристик сложных соединений, распределения электронной плотности в них и выявления межмолекулярных взаимодействий [1].
В настоящей задаче используется простой и эффективный способ интерпретации ЯМР 13С спектров. На сегодняшний день спектроскопия ЯМР 13С превратилась в стандартный метод, доступный в химической лаборатории. Если принять во внимание, что химик-органик в первую очередь интересуется строение углеродного скелета, то станет ясным, что с помощью ЯМР 13С можно получать значительно более прямую информацию о структуре органической молекулы, чем из протонного спектра. В частности, в нем обнаруживается сигналы четвертичных атомов углерода и атомов углерода функциональных групп (С=N, C=O, C=NR и т. д.), что резко увеличивает объем структурной информации. Кроме того, более широкий диапазон химических сдвигов, приблизительно 250 м. д., при той же (сравнительно с ЯМР 1Н) ширине линии (0.3 Гц или меньше) необычно сильно увеличивает эффективное разрешение. Поэтому метод ЯМР 13С стал также чрезвычайно важным инструментом установления структуры сложных соединений, а также синтетических и биологических полимеров.
Важно подчеркнуть, что спектроскопия ЯМР 13С не может заменить ЯМР 1Н, который остается наиболее широко используемым спектроскопическим методом. Оба метода дополняют друг друга. Определение структуры органических молекул по сочетанию данных ЯМР 13С и ЯМР 13Н имеет поэтому очень большое значение и почти избавляет от необходимости проводить дополнительные измерения, в особенности тогда когда известен масс-спектр вещества.
Химические сдвиги. Химические сдвиги ядер 13С в органических молекулах занимают область около 250 м. д., а включая крайние значения в высоком поле для тетаиодметана и в слабом поле для карбониевых ионов, даже 650 м. д. Общий обзор представлен на рис. 1.
Как и в протонном резонансе, ![]() -шкалу
химических сдвигов 13С можно разделить на
подобласти резонансных сигналов алифатических,
олефиновых и ацетиленовых углеводородов. Атомы
углерода карбонильных групп дезактивированы
наиболее сильно, и их сигналы образуют отдельную
область в самом слабом поле. В качестве
внутреннего эталона для ЯМР 13С был
предложен и принят тетаметилсилан (ТМС). Его
преимущество состоит в том, что большинство
-шкалу
химических сдвигов 13С можно разделить на
подобласти резонансных сигналов алифатических,
олефиновых и ацетиленовых углеводородов. Атомы
углерода карбонильных групп дезактивированы
наиболее сильно, и их сигналы образуют отдельную
область в самом слабом поле. В качестве
внутреннего эталона для ЯМР 13С был
предложен и принят тетаметилсилан (ТМС). Его
преимущество состоит в том, что большинство ![]() -значений 13С оказываются
положительными.
-значений 13С оказываются
положительными.
Рис. 1. Шкала химических сдвигов 13С органических соединений.
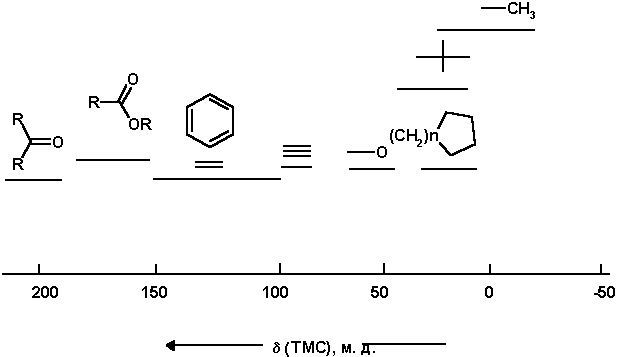
Рис 2. Химические сдвиги 13С функциональных групп
Методы отнесения сигналов. Сейчас для отнесения резонансных сигналов 13С экспериментатор имеет большой выбор методов. Большинство из них использует определенные типы развязки от протонов. Например, после записи обычного спектра с широкополосным подавлением 1Н обычно измеряют спектр неполного двойного резонанса. Так можно различить в спектре первичные, вторичные, третичные и четвертичные атомы углерода. Кроме того, возможность импульсной развязки открывает путь для наблюдения констант 1Н-13С. По крайней мере прямые константы через одну связь обычно находятся с точностью, достаточной для использования при отнесении, даже если совершенно корректное определение этих параметров и невозможно без проведения полного анализа спектра. Например, в циклопропане 1J (1Н,13С) составляет161 Гц, а в метане – толко 125 Гц. Поэтому метиленовые группы трехчленных циклов легко распознать по большому триплетному расщеплению их сигнала 13С.
Эмпирические корреляции. Уже на начальном этапе развития спектроскопии ЯМР 13C было предложено большое число эмпирических соотношений между химическими сдвигами и молекулярным строением, которые наиболее полезны для анализа спектров 13С. Некоторые из них можно разумно объяснить на основе теоретических представлений, но можно рассматривать как чисто эмпирические корреляции, которые более или менее согласованы.
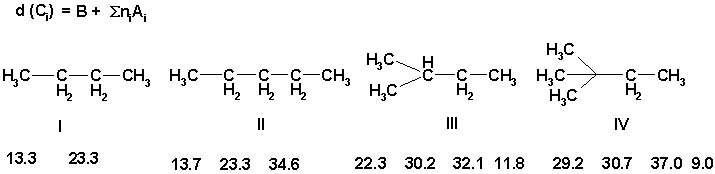
Лучше всего изучены эффекты заместителей в
углеводородах. Например, замена водородного
атома на метильную группу в алкильной цепи
вызывает дезэкранирование ![]() - и
- и ![]() -углеродов на 9-10 м.д. и
экранирование
-углеродов на 9-10 м.д. и
экранирование ![]() -углерода на 2.5
м.д.. Эти эффекты отчетливы подтверждаются при
сравнении данных для пентана II и
разветвленных углеводородов III, IV c
химическими сдвиги в бутане I как в эталонном
соединении. Они строго постоянны для всей серии и
можно использовать эмпирическое правило
аддитивности для предсказания химического
сдвига углеродов в алкановой цепи:
-углерода на 2.5
м.д.. Эти эффекты отчетливы подтверждаются при
сравнении данных для пентана II и
разветвленных углеводородов III, IV c
химическими сдвиги в бутане I как в эталонном
соединении. Они строго постоянны для всей серии и
можно использовать эмпирическое правило
аддитивности для предсказания химического
сдвига углеродов в алкановой цепи:
Постоянная В здесь почти равна
химическому сдвигу метана (![]() -2.3),
Аi – инкременты химического сдвига для
-2.3),
Аi – инкременты химического сдвига для ![]() -,
-, ![]() - или
- или ![]() -заместителей, ni - число
заместителей в данном положении. C помощью
регрессионного анализа были найдены значения А
-заместителей, ni - число
заместителей в данном положении. C помощью
регрессионного анализа были найдены значения А![]() = +9.1, А
= +9.1, А![]() = +9.4 и А
= +9.4 и А![]() = -2.6 м.д. Были предложены и более
разработанные уравнения, содержащие поправочные
члены, учитывающие разветвления.
= -2.6 м.д. Были предложены и более
разработанные уравнения, содержащие поправочные
члены, учитывающие разветвления.
Метильное замещение в циклоалканах также
характеризуется типичными инкрементами, но
отличающимися от таковых в соединениях с
открытой цепью. Для циклогексана (![]() 27.6) были найдены следующие
параметры для экваториального и аксиального
заместителей:
27.6) были найдены следующие
параметры для экваториального и аксиального
заместителей:
Аксиальный |
Экваториальный | |
| +1.4 | +6.0 |
|
| +5.4 | -9.0 |
|
| -6.4 | 0 |
Различия в эффектах между аксиальным и экваториальным заместителями важн для конформациооного анализа, где по данным ЯМР 13С можно определить стереохимию различных конформеров.
Яркий пример представляют два циклолгексана V
и VI, где разные ![]() -эффекты
характеризуют аксиальный и экваториальный
изомеры.
-эффекты
характеризуют аксиальный и экваториальный
изомеры.
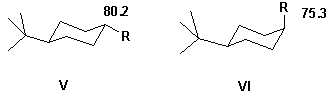
В случае алкенов можно предсказать химический
сдвиг олефинового углерода С по инкрементам,
приведенным ниже, использовав как точку отсчета
химический сдвиг этилена (123.2 м. д.). Интересно
различие знаков ![]() -эффекта
(инкременты для С
-эффекта
(инкременты для С![]() и С
и С![]() ' соответственно):
' соответственно):
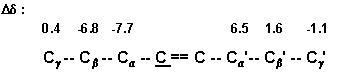
Разумеется такие схемы можно расширить и на другие заместители. В литературе можно найти много разных правил аддитивности для различных классов соединений. В таблице 1 приведены значения эффектов заместителей для некоторых типов органических соединений.
Таблица 1. Изменения химических сдвигов ![]() (м. д.) ядер 13С в замещенных
алканах, алкенах и бензолах под влиянием
заместителей.
(м. д.) ядер 13С в замещенных
алканах, алкенах и бензолах под влиянием
заместителей.
| Заместитель | Алканы |
Алкены |
Бензолы (128.5) |
||||||
| F | 70.1 | 7.8 | -6.8 | 24.9 | -34.3 | 35.1 | -14.3 | 0.9 | -4.4 |
| Cl | 31.0 | 10.0 | -5.1 | 2.6 | -6.1 | 6.4 | 0.2 | 1.0 | -2.0 |
| Br | 18.9 | 11.0 | -3.8 | -7.9 | -1.4 | -5.4 | 3.3 | 2.2 | -1.0 |
| I | -7.2 | 10.9 | -1.5 | -38.1 | 7.0 | -32.3 | 9.9 | 2.5 | -0.4 |
| OMe | 49.0 | 10.1 | -6.2 | 29.4 | -38.9 | 30.2 | -14.7 | 0.9 | -8.1 |
| OH | 26.9 | -12.7 | 1.4 | -7.3 | |||||
| OCOMe | 52.0 | 6.5 | -6.0 | 18.2 | -27.1 | 23 | -6 | 1 | |
| NH2 | 19.2 | -12.4 | 1.3 | -9.5 | |||||
| NMe2 | 28.3 | 11.3 | -5.1 | - | - | 22.4 | -15.7 | 0.8 | -11.8 |
| NPh2 | - | - | 19.3 | -4.4 | 0.6 | -5.0 | |||
| NCO | 5.7 | -3.6 | 1.2 | -2.8 | |||||
| NO2 | 61.6 | 3.1 | -4.6 | 22.3 | -0.9 | 19.6 | -5.3 | 0.8 | 6.0 |
| SCMe2 | 4.5 | 9.0 | -0.3 | 0 | |||||
| CN | 3.1 | 2.4 | -3.3 | -15 | 15 | -16.0 | 3.5 | 0.7 | 4.3 |
| COOH | 20.1 | 2.0 | -2.8 | 4.2 | 8.9 | 2.4 | 1.6 | -0.1 | -0.1 |
| CHO | 29.9 | -0.6 | -2.7 | 13.6 | 13.2 | 9.0 | 1.2 | 1.2 | 6.0 |
| COMe | 9.3 | 0.2 | 0.2 | 4.2 | |||||
| COOH | - | - | 2.4 | 1.6 | -0.1 | 4.8 | |||
| COO- | - | - | 7.6 | 0.8 | 0.0 | 2.8 | |||
| COOMe | - | - | 2.1 | 1.2 | 0.0 | 4.4 | |||
| COCl | 4.6 | 2.9 | 0.6 | 7.0 | |||||
| CH=CH2 | 21.5 | 6.9 | -2.1 | 14.8 | -5.8 | 7.6 | -1.8 | -1.8 | -3.5 |
| C=CH | 4.4 | 5.6 | -3.4 | - | - | -6.1 | 3.8 | 0.4 | -0.2 |
| CH3 | 9.1 | 9.4 | -2.5 | 12.9 | -7.4 | 9.3 | 0.6 | 0 | -3.1 |
| C2H5 | 15.7 | -0.6 | -0.10 | -2.8 | |||||
| CH(CH3)2 | 20.7 | -2.0 | 0 | -2.5 | |||||
| C(CH3)3 | 22.1 | -3.4 | -0.4 | -3.1 | |||||
| циклопропил | 15.3 | -3.3 | -0.6 | -3.6 | |||||
| CH2Сl | 9.1 | 0.0 | 0.2 | -0.2 | |||||
| CH2Br | 9.2 | 0.1 | 0.4 | -0.3 | |||||
| CF3 | 2.6 | -2.2 | 0.3 | 3.2 | |||||
| CH2OH | 13.0 | -1.4 | 0.0 | -1.2 | |||||
| C6H5 | 22.1 | 9.3 | -2.6 | 12.5 | -11.0 | 13,0 | -1.1 | 0.5 | 1.0 |
Эти значения строго постоянны для всей серии соединений и потому можно использовать эмпирическое правило аддитивности для предсказания химических сдвигов углеродов в различных модельных соединениях, например, циклогексане, этилене, бензоле, адамантане и т. д.
Расчет химических сдвигов углерода ![]() (Сi) в исследуемом
соединении проводится по формуле:
(Сi) в исследуемом
соединении проводится по формуле:
![]() (Сi) = M(Ci) + S
jIj(Ci) (1)
(Сi) = M(Ci) + S
jIj(Ci) (1)
M(Ci) - химический сдвиг i-углерода в модельном соединении,
Ij - инкременты j-го заместителя на Сi.
Одним из наиболее важных условий для разработки корректно и точно работающей аддитивной схемы для расчета химических сдвигов 13С серии изоструктурных соединений является детальное изучение спектров 13С ЯМР соединений – родоначальников рядов. Второе, не менее важное требование, заключается в необходимости весьма детального воспроизведения условий регистрации спектров 13С ЯМР всей серии соединений; при этом наибольшее значение имеют постоянство растворителя, концентрации исследуемого вещества и температуры, при которой производится спектральный эксперимент.
Для более детального изучения вопроса о способах отнесения сигналов 13С и о возможностях использования аддитивных схем смотри [1, глава 10].
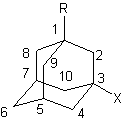
Порядок выполнения работы. В настоящей работе предлагается освоение методики доказательства строения производных адамантана 1 на основе аддитивных закономерностей в поведении химических сдвигов ядер 13С. Спектроскопия 13С ЯМР является одним из наиболее эффективных методов при установлении структуры адамантановых производных, а сам адамантан со своей достаточно жесткой и свободной от напряжения структурой отличной моделью для решения различных спектральных задач, связанных с внутримолекулярным взаимодействием заместителей - механизма экранирования химических сдвигов ядер 13С в органических молекулах , передачи полярных эффектов заместителей в насыщенных системах [2, 3].
В качестве исследуемых соединений взяты 1,3-, 2,5- дизамещенные и 2,5,7-тризамещенные адамантаны 1-X-3-Y-Ad 2, 2-X-5-Y-Ad 3, 2-X-5-Y-7-ZAd 4, причем практически во всех случаях один из заместителей в узловом или мостиковом положении является ароматическим или алкильным радикалом. В качестве функциональных заместителей могут быть введены галоид-, гидрокси-, карбокси-, амино или ациламиногруппы.
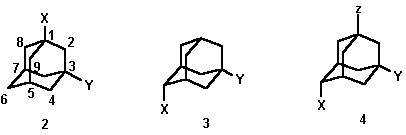
В ходе выполнения задачи:
1. Определите в спектре ЯМР 13С области сигналов углеродов адамантанового ядра и заместителей, установите тип замещения в адамантановом ядре и сделайте предположение о характере заместителей.
2. Отнесите сигналы углеродов адамантанового производного в спектре на основе аддитивных закономерностей в поведении химических сдвигов ядер 13С.
Расчет химических сдвигов 13С адамантанового ядра проводится по следующей формуле:
![]() (Сi)расчет
=
(Сi)расчет
= ![]() (Ci)Ad +
(Ci)Ad + ![]()
![]() (Ci)XAd
+
(Ci)XAd
+ ![]()
![]() (Ci)YAd
(2)
(Ci)YAd
(2)
![]() (Ci)Ad - химический
сдвиг i-го углерода адамантана,
(Ci)Ad - химический
сдвиг i-го углерода адамантана,
![]()
![]() (Ci)XAd
и
(Ci)XAd
и ![]()
![]() (Ci)YAd
- инкременты заместителей X и Y на СI атом
углерода адамантанового ядра.
(Ci)YAd
- инкременты заместителей X и Y на СI атом
углерода адамантанового ядра.
Результаты расчета по аддитивной схеме представляются в виде таблицы 2.
Инкременты химических сдвигов атомов 13С
адамантанового фрагмента при введении
заместителя R в узловое ![]()
![]() (Ci)1-RAd или
мостиковое
(Ci)1-RAd или
мостиковое ![]()
![]() (Ci)2-RAd
положения адамантанового ядра приведены в
работе [2] и табл. 3, 4. В таблице 5 приведены средние
значения инкрементов заместителй на химические
сдвиги адамантанового ядра в 1- и 1,3-дизамещенных
адамантанах.
(Ci)2-RAd
положения адамантанового ядра приведены в
работе [2] и табл. 3, 4. В таблице 5 приведены средние
значения инкрементов заместителй на химические
сдвиги адамантанового ядра в 1- и 1,3-дизамещенных
адамантанах.
3. Определите отклонения от аддитивности ![]() для каждого атома углерода
адамантанового ядра и оценить величину
внутримолекулярного взаимодействия
заместителей.
для каждого атома углерода
адамантанового ядра и оценить величину
внутримолекулярного взаимодействия
заместителей.
13
С ЯМР спектроскопия позволяет обнаружить в органической молекуле достаточно слабые внутримолекулярные взаимодействия заместителей, проявлением которых, как полагают является отклонение от аддитивности при расчете химических сдвигов 13С. Величина неаддитивности (![]()
![]() (Сi)расчет
=
(Сi)расчет
= ![]()
![]() (Сi)эксп.
-
(Сi)эксп.
- ![]()
![]() (Сi)расчет
(3)
(Сi)расчет
(3)
4. Определите возможное строение заместителей в адамантановом ядре и сделайте предположение о природе функциональных групп. Используйте данные таблицы 1.
Определите структурную формулу исследуемого соединения X-Y-Ad, и представьте результаты расчета по аддитивной схеме в следующем виде:
Таблица 2. Отнесение сигналов 13С адамантанового ядра по аддитивной схеме для ди- замещенных адамантанов..
| Атом | С1 | С2 | С3 | С4 | С5 | С6 | С7 | С8 | С9 | С10 |
| 28.61 | 38.02 | 28.61 | 38.02 | 28.61 | 38.02 | 28.61 | 38.02 | 38.02 | 38.02 | |
Таблица 3. Инкременты химических сдвигов углеродов 13C адамантанового ядра в 1-замещенных адамантанах. (1-R-Ad).
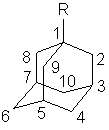
| Соединение |
|
||||
| N | R | C1 |
C 2,8,9 |
C 3,5,7 |
C 4,6,10 |
| 1 | H | 28.61 | 38.02 | 28.61 | 38.02 |
| 2 | HO- | 39.30 | 7.10 | 1.90 | -2.12 |
| 3 | MeCONH- | 25.04 | 2.63 | 0.55 | -2.11 |
| 4 | Cl [20] | 38.50 | 9.95 | 3.27 | -2.02 |
| 5 | Br | 28.04 | 11.21 | 3.93 | -2.54 |
| 6 | C6H5 | 7.43 | 5.04 | 0.27 | -1.29 |
| 7 | 4-MeC6H4 | 7.07 | 5.12 | 0.27 | -1.32 |
| 8 | 4-EtC6H4 | 7.15 | 5.18 | 0.34 | -1.25 |
| 9 | 3,4-Me2C6H3 | 7.01 | 5.18 | 0.35 | -1.23 |
| 10 | 3,5-Me2C6H3 | 7.23 | 5.12 | 0.33 | -1.23 |
| 11 | 4-(1-Ad)C6H4 | 7.12 | 5.12 | 0.29 | -1.24 |
| 12 | 4-MeCONHC6H4 | 7.16 | 5.07 | 0.24 | -1.33 |
| 13 | 4-MeSC6H4 | 7.22 | 5.04 | 0.26 | -1.33 |
| 14 | 3,4-(MeO)2C6H3 | 7.13 | 5.27 | 0.33 | -1.33 |
| 15 | 4-HOOCCH2OC6H4 | 7.02 | 5.24 | 0.32 | -1.30 |
| 16 | 6-Тетралил | 7.16 | 5.07 | 0.24 | -1.33 |
| 17 | 3,5-ди-трет-С4H9C6H4 | 7.41 | 5.50 | 0.53 | -1.12 |
| 18 | 4-HOOCCH2OC6H4 | 7.28 | 5.14 | 0.33 | -1.24 |
| 19 | 4-NO2C6H4 | 8.27 | 4.67 | 0.00 | -1.62 |
| 20 | 4-MeCOC6H4 | 8.14 | 4.78 | 0.13 | -1.44 |
| 21 | 4-MeSOC6H4 | 7.86 | 4.93 | 0.14 | -1.44 |
| 22 | 4-MeSO2C6H4 | 7.97 | 4.59 | -0.11 | -1.71 |
| 23 | 2-C10H7 | 7.72 | 5.03 | 0.35 | -1.18 |
| 24 | 6-Me-2-C10H7 | 7.54 | 5.01 | 0.29 | -1.23 |
| 25 | 6-MeO-2-C10H6 | 7.49 | 5.12 | 0.38 | -1.18 |
| 26 | 6-C6H5NH-2-C10H6 | 7.51 | 5.08 | 0.37 | -1.17 |
| 27 | 5-(1-Ad)-2-тиенил | 7.26 | 6.81 | 0.21 | -1.37 |
| 28 | 5-н-Bu-2-тиенил | 7.49 | 6.89 | 0.32 | -1.34 |
| 29 | 3-Бензотиенил | 8.35 | 3.98 | 0.21 | -0.97 |
| 30 | MeCH2CH2 [21] | 4.0 | 5.4 | 0.4 | -0.4 |
| 31 | MeCH2CH2CH2 [21] | 3.8 | 4.8 | 0.5 | -0.4 |
| 32 | Me2CH [22] | 6.0 | 1.6 | 0.5 | -0.3 |
| 33 | 1-Ad | 5.70 | -2.46 | 0.38 | -0.46 |
| 34 | MeCH=CH | 5.99 | 4.54 | 0.08 | -0.97 |
| 35 | CH2=CHCH2 | 4.03 | 4.35 | 0.16 | -0.90 |
| 36 | 1-Циклогексенил | 8.21 | 2.85 | 0.19 | -0.92 |
| 37 | MeCH2CH2(OH) | 8.05 | -0.06 | -0.26 | -0.78 |
| 38 | MeCH2CH2CH2(OH) | 7.92 | -0.12 | -0.29 | -0.79 |
| 39 | MeCH2CH2(OH)CH3 | 10.61 | -3.06 | -0.08 | -0.97 |
| 40 | MeCH2CH2(NHCOMe) | 7.50 | 0.45 | -0.39 | -1.09 |
| 41 | MeCH2CH2(NHCOMe)CH3 | 12.24 | -1.30 | -0.02 | -1.02 |
| 42 | MeCO | 17.66 | 0.05 | -0.81 | -1.63 |
| 43 | MeCH2CO | 17.21 | 0.01 | -0.88 | -1.72 |
| 44 | POCl2 | 19.78 24.6Hz |
-3.23 –3.0 |
-1.29 –1.2 |
-2.28 –1.8 |
| 45 | PO(OH)2 | 4.37 | -2.54 | -1.8 | -1.6 |
| 46 | PO(NH)2 | 9.12 | -1.52 | 0.35 | -0.3 |
| 47 | PO(OMe)2 | 6.3 | -2.3 | -1.4 | -1.3 |
Таблица 4. Инкременты химических заместителей на химические сдвиги углеродов 13C адамантанового ядра в 2-замещенных адамантанах. (2-RAd).
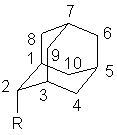
| Соединение |
|
|||||||
| N | R | C 1,3 |
C2 |
C 4,10 |
C5 |
C6 |
C7 |
C 8,9 |
| 1 | HO- | 5.89 | 36.39 | -7.04 | -1.11 | -0.47 | -1.57 | -1.55 |
| 2 | Me- | 5.07 | 0.89 | -6.77 | -0.23 | 0.51 | -0.57 | 1.32 |
| 3 | MeCONH | 3.31 | 25.38 | -6.24 | -1.38 | -0.48 | -1.49 | -0.86 |
| 4 | O= | 18.16 | 179.80 | 1.05 | -1.32 | -1.91 | -1.32 | 1.05 |
| 5 | C6H5- | 2.47 | 8.79 | -6.03 | -0.46 | -0.07 | -0.70 | 1.19 |
| 6 | 4-MeC6H5- | 2.42 | 8.41 | -6.09 | -0.51 | -0.09 | -0.76 | 1.12 |
| 7 | 4-BrC6H5- | 2.26 | 8.26 | -6.29 | -0.72 | -0.35 | -1.06 | 0.89 |
| 8 | 4-ClC6H5- | 2.31 | 8.20 | -6.30 | -0.70 | -0.34 | -1.03 | 0.89 |
| 9 | 3-CF3C6H5- | 2.42 | 8.70 | -6.23 | -0.62 | -0.33 | -0.92 | 0.95 |
Таблица 5. Инкременты заместителей на химические сдвиги углеродов 13C ("ґ, ј.д.) и величины отклонений от аддитивности (", м.д.) для 1- моно- и 1,3-дизамещенных адамантанов.
Инкрименты |
|
|||||||
| N | C1 |
C2 |
C3 |
C4,10 |
C5,7 |
C6 |
C8,9 |
|
| 1 | 7.43 |
5.04 | 0.27 | -1.29 | 0.27 | -1.29 | 5.04 | |
| 2 | 7.11 |
5.14 | 0.27 | -1.30 | 0.27 | -1.30 | 5.14 | |
| 3 | 7.90 |
4.80 | 0.05 | -1.60 | 0.05 | -1.60 | 4.80 | |
| 4 | 22.70 | -3.82 | -0.53 | -3.05 | ||||
| 5 | - | 23.77 | - | -1.32 | - | -0.82 | 0.48 | |
| 6 | 32.2 | 0.1 | -1.0 | 1.2 | ||||
| 7 | 17.7 | -3.0 | 0.7 | 0.3 | ||||
| 8 | 33.8 | 6.8 | -4.0 | |||||
| 9 | -1.8 | 0.1 | 0.3 | 0.5 | ||||
| 10 | -0.5 | 0.1 | 0.1 | 0.3 | ||||
| 11 | -1.6 | 0.1 | 0.2 | 0.4 | ||||
| 12 | 1.84 | 0.18 | 0.85 | 0.52 | 0.08 | 0.50 | 0.84 | |
| 13 | 0.85 | 0.74 | 0.85 | 0.44 | 0.34 | 0.40 | 0.44 | |
| 14 | 1.58 | 0.74 | -1.07 | 1.46 | 0.40 | 0.90 | 1.05 | |
| 15 | 0.75 | 0.66 | 0.13 | - | 0.25 | 0.17 | 0.22 | |
| 16 | 1.05 | 0.79 | 0.98 | - | 0.44 | 0.50 | 0.47 | |
Литература