|
Учебные материалы по физической химии
Реальные газы
1.6. Термодинамические функции
реальных газов
Уравнения состояния, представляя
самостоятельный интерес, дают возможность также
рассчитывать термодинамические функции
реальных систем (не только газов, но и жидкостей,
если имеется уравнение, описывающее всю область
состояний от газа до жидкости).
При нахождении производных термодинамических
функций по объему при T = const удобно
исходить из соотношений, связывающих
рассматриваемую функцию с энергией Гельмгольца F,
т.к. она характеристична относительно переменных
T и V. Для мольных величин запишем:
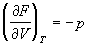 ; ;
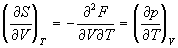 ; ;
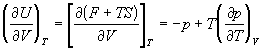 ; (1.26) ; (1.26)
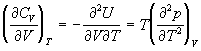 и т.д. и т.д.
Производные по давлению при T = const
найдем с учетом того, что характеристической
функцией относительно переменных T и p
является энергия Гиббса G:
Таблица 1.4. Некоторые уравнения
состояния реальных газов
Уравнение |
Обычная форма |
Приведенная форма |
pc |
Tc |
Vc |
Zc |
| Ван-дер-Ваальса (1873) |
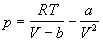
|
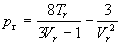 |
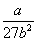
|
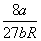
|
3b |
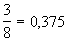
|
| Дитеричи (1898) |
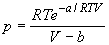
|
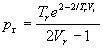 |
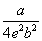
|
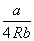
|
2b |
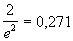
|
| Бертло (1900) |
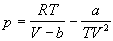
|
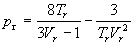 |
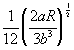
|
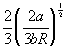
|
3b |
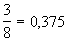
|
| Битти-Бриджмена (1927) |
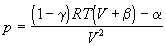 , ,
где 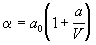 , , 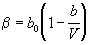 , , 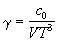
|
|
|
|
|
|
| Вириальное (1901) (Камерлинг-Оннес) |
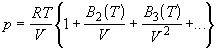
|
|
|
|
|
|
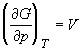 ; ;
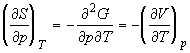 ; ;
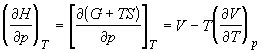 ; (1.27) ; (1.27)
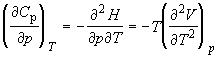 , и т.д. , и т.д.
В правой части выражений (1.26) и (1.27) стоят
переменные T, p и V и производные,
которые могут быть выражены через эти переменные
с помощью уравнения состояния. Поэтому изменение
некоторой функции A (где A = F, G, U,
H, S и др.) может быть найдено с помощью
соотношений:
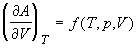 ; ; 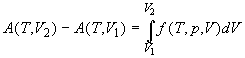 ; (1.28) ; (1.28)
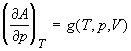 ; ; 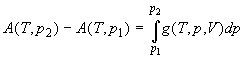 ; (1.29) ; (1.29)
При T = const только одна переменная (p
или V) является независимой. В выражении (1.28)
это переменная V, т.е. p = f(V). В
выражении (1.29) это переменная p, т.е. V = g(p).
Интегралы (1.28) и (1.29) можно рассчитать, если
известна связь между переменными p и V при T
= const, т.е. если известно уравнение состояния.
Для идеального газа из уравнения состояния pV
= RT находим:
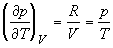 ; ; 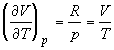 . .
Зависимости термодинамических функций
идеального газа от объема выражаются следующими
соотношениями:
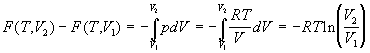 ; (1.30) ; (1.30)
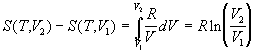 ; (1.31) ; (1.31)
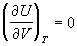 ; ; 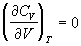 ; ; 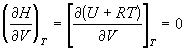 . (1.32) . (1.32)
Зависимости от давления имеют вид:
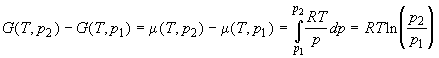 ; (1.33) ; (1.33)
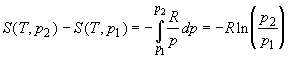 ; (1.34) ; (1.34)
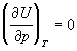 ; ; 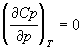 ; ; 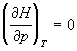 . (1.35) . (1.35)
За стандартное при произвольной
температуре принимается состояние идеального
газа при той же температуре и стандартном
давлении p° = 1 бар. Объем идеального газа в
стандартных условиях V° = RT/p° .
Стандартное значение некоторой функции A
можно записать в виде: A° = A(T, p° ) = A(T,
V° ). Разность между мольными значениями
термодинамических функций идеального газа в
рассматриваемом и стандартном состоянии
представляется как:
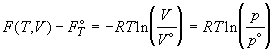 ; ;
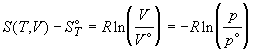 ; (1.36) ; (1.36)
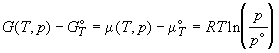 ; ;
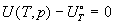 ; ; 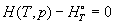
Рассмотрим термодинамические функции реальных
газов, отсчитываемые от стандартного
состояния. Вывод основан на том, что при p  0 (V 0 (V  Ґ ) реальный газ ведет себя как идеальный.
Можно исходить из соотношений (1.28) или (1.29).
Соотношения (1.29) удобнее использовать тогда,
когда уравнение состояния дает зависимость p(V,
T) в явном виде (как, например, уравнение
Ван-дер-Ваальса). Ґ ) реальный газ ведет себя как идеальный.
Можно исходить из соотношений (1.28) или (1.29).
Соотношения (1.29) удобнее использовать тогда,
когда уравнение состояния дает зависимость p(V,
T) в явном виде (как, например, уравнение
Ван-дер-Ваальса).
Рассмотрим выражение для энергии Гельмгольца F.
Изменение F при изотермическом изменении
объема реального газа будет:
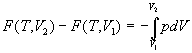 . .
Для гипотетического идеального газа,
образованного теми же частицами, но
невзаимодействующими:
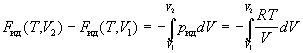 . .
При V1 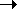 Ґ , F(T,
V1) Ґ , F(T,
V1)  Fид(T,
V1). Опуская индекс при V2,
запишем: Fид(T,
V1). Опуская индекс при V2,
запишем:
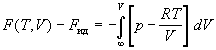 . (1.37) . (1.37)
С учетом (1.36) найдем разность между значениями F
в рассматриваемом и стандартном состоянии:
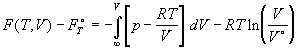 . (1.38) . (1.38)
Тогда для энтропии реального газа получаем:
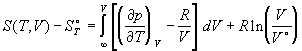 . (1.39) . (1.39)
Внутренняя энергия реального газа равна:
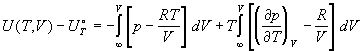 . (1.40) . (1.40)
Для энтальпии получаем:
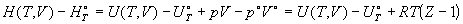 , (1.41) , (1.41)
где Z = pV/RT - фактор сжимаемости.
Аналогично для энергии Гиббса можно записать:
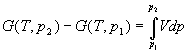 ; ;
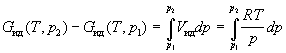 . .
При p1  0, G(T,
p1) 0, G(T,
p1)  Gид(T,
p1). Опуская индекс при p2,
получим: Gид(T,
p1). Опуская индекс при p2,
получим:
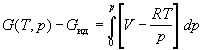 . (1.42) . (1.42)
Раскрыв зависимость Gид(T, p),
получим:
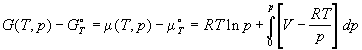 . (1.43) . (1.43)
Энтропия реального газа как функция давления
имеет вид:
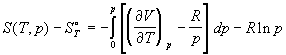 . (1.44) . (1.44)
Аналогичным образом можно получить выражения и
для других термодинамических функций.
|

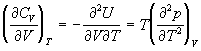 и т.д.
и т.д.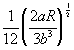
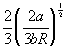
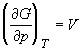 ;
;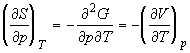 ;
;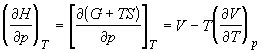 ; (1.27)
; (1.27)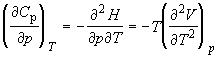 , и т.д.
, и т.д.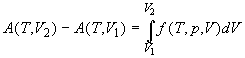 ; (1.28)
; (1.28)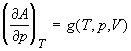 ;
; 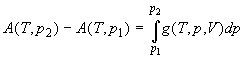 ; (1.29)
; (1.29)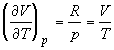 .
.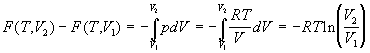 ; (1.30)
; (1.30)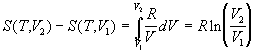 ; (1.31)
; (1.31)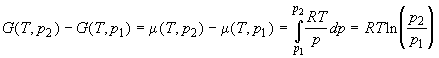 ; (1.33)
; (1.33)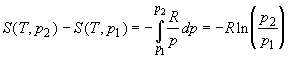 ; (1.34)
; (1.34) ;
;  ;
; 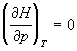 . (1.35)
. (1.35)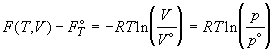 ;
;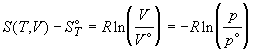 ; (1.36)
; (1.36)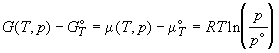 ;
;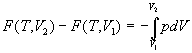 .
.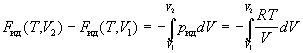 .
.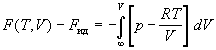 . (1.37)
. (1.37)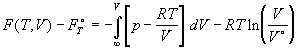 . (1.38)
. (1.38)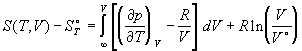 . (1.39)
. (1.39)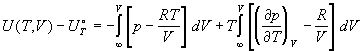 . (1.40)
. (1.40)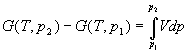 ;
;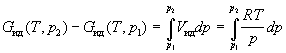 .
.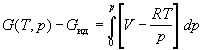 . (1.42)
. (1.42)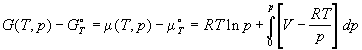 . (1.43)
. (1.43)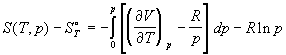 . (1.44)
. (1.44)