2.2.3. Газофазная химическая реакция
Пусть газофазная реакция протекает (возможно, с участием
катализатора) по схеме
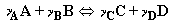 . .
В соответствии с принятым стандартом стехиометрические коэффициенты 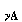 и и 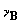 исходных веществ считаем
отрицательными, коэффициенты исходных веществ считаем
отрицательными, коэффициенты 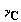 и и 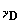 продуктов реакции – положительными, причем продуктов реакции – положительными, причем 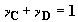 .Будем предполагать, что
компоненты реакционной смеси проявляют свойства идеальных газов и, в частности,
энтальпия их смешения равна нулю. .Будем предполагать, что
компоненты реакционной смеси проявляют свойства идеальных газов и, в частности,
энтальпия их смешения равна нулю.
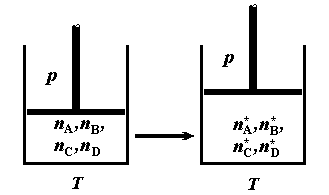
Рис.2.5. Схема неравновесного
изобарно-изотермического химического превращения смеси веществ.
Простейшая схема самопроизвольного химического превращения веществ
изображена на рис. 2.5. В термостатированный реакционный сосуд, в котором
поддерживается с помощью поршня постоянное давление p, вводится смесь,
состоящая из 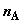 , , 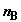 , , 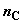 и и 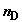 молей компонентов A, B, C и D. Парциальные давления
компонентов равны молей компонентов A, B, C и D. Парциальные давления
компонентов равны 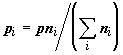 , где i = A, B,C и D . , где i = A, B,C и D .
Смесь занимает объем 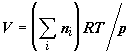 . Первоначальный состав смеси не соответствует химическому
равновесию в системе. После инициирования химической реакции (например, внесением
катализатора) происходит самопроизвольное изменение состава смеси вплоть до
достижения химического равновесия, соответствующего заданным p и
T. Обозначим равновесные давления компонентов через . Первоначальный состав смеси не соответствует химическому
равновесию в системе. После инициирования химической реакции (например, внесением
катализатора) происходит самопроизвольное изменение состава смеси вплоть до
достижения химического равновесия, соответствующего заданным p и
T. Обозначим равновесные давления компонентов через 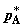 , , 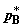 , , 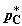 и и 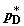 (их соотношение определяется
константой равновесия реакции) и соответствующие значения чисел молей
компонентов через (их соотношение определяется
константой равновесия реакции) и соответствующие значения чисел молей
компонентов через 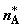 , , 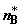 , , 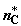 и и 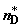 . Произошедшие изменения чисел молей в системе удовлетворяют
стехиометрии реакции: . Произошедшие изменения чисел молей в системе удовлетворяют
стехиометрии реакции:
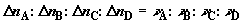 , (2.14) , (2.14)
где 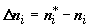 .
Суммарное изменение числа молей в системе составит .
Суммарное изменение числа молей в системе составит
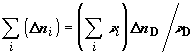 , (2.15) , (2.15)
а изменение объема равно
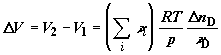 . (2.16) . (2.16)
В смеси реагентов – идеальных газов молярная энтальпия реакции 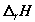 , т.е. изменение
энтальпии в расчете на каждый моль образовавшихся продуктов, или, в нашем
примере, на , т.е. изменение
энтальпии в расчете на каждый моль образовавшихся продуктов, или, в нашем
примере, на 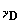 молей продукта D, не зависит от текущего состава
реакционной смеси (что связано с нулевой энтальпией смешения компонентов).
Поэтому можно записать молей продукта D, не зависит от текущего состава
реакционной смеси (что связано с нулевой энтальпией смешения компонентов).
Поэтому можно записать
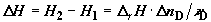 , (2.17) , (2.17)
где H1 и H2 –
энтальпии конечного и начального состояния системы.
Изменение энтальпии при p = const равно количеству
теплоты, подведенному к системе. Теплообмен между реакционной смесью и
термостатом будем считать квазиравновесным процессом, предполагая, что скорость
реакции мала по сравнению со скоростью установления термического равновесия
между реактором и термостатом (что регулируется, например, количеством
внесенного катализатора или перемешиванием смеси). Тогда обратимая часть
изменения энтропии реакционной смеси составит
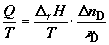 . (2.18) . (2.18)
Для дальнейшего удобно изменение энтальпии представить в виде суммы 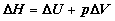 , где , где 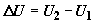 – изменение
внутренней энергии системы. С учетом (2.16) – изменение
внутренней энергии системы. С учетом (2.16)
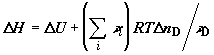 . (2.19) . (2.19)
Каково производство энтропии внутри системы из-за необратимого характера самого
химического превращения? Ответ на этот вопрос получим, произведя такое же
изменение состояния системы по равновесной траектории с помощью гипотетического
устройства, называемого ящиком Вант-Гоффа.
Это устройство включает в себя (рис.2.6) термостатируемый реакционный
объем, снабженный подвижным поршнем для поддержания постоянного давления и
вентилями для напуска и ввода газовых смесей, и четыре хемостата индивидуальных
компонентов смеси. Перенос веществ между хемостатами и реакционным объемом
осуществляется через селективно проницаемые мембраны, снабженные задвижками. В
двух вспомогательных резервуарах находятся газовые смеси исходного и конечного
(равновесного) составов.
После заполнения реакционного сосуда исходной смесью требуемое превращение
осуществляется в четыре стадии. Первая стадия – равновесное разделение смеси на
индивидуальные компоненты. Этот процесс проводится путем синхронного
перемещения пяти поршней, так что в реакционном сосуде непрерывно
поддерживается давление p, а в каждом отдельном хемостате –
давление, равное парциальному давлению индивидуального газа в исходной смеси,
т.е. pi.
Вторая стадия – изотермическое расширение индивидуальных газов в хемостатах
от давлений pi. до равновесных давлений 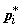 . .
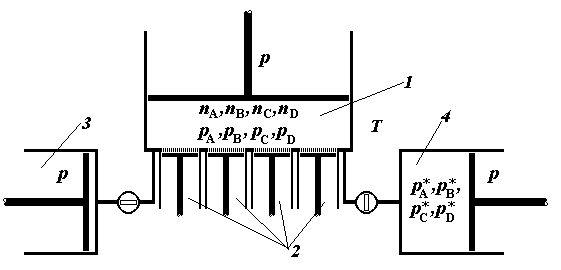
Рис.2.6. Гипотетическое устройство
для осуществления равновесного процесса химического превращения смеси веществ
(ящик Вант-Гоффа): 1 – реакционный сосуд: 2 – хемостаты
индивидуальных компонентов; 3 – резервуар исходной смеси; 4 –
вспомогательный резервуар реакционной смеси равновесного состава. Положение
поршней на схеме соответствует исходному состоянию системы после напуска смеси
в реакционный сосуд.
Третья стадия – собственно химическое превращение в квазиравновесном режиме.
Сначала реакционный сосуд заполняется некоторым количеством равновесной газовой
смеси из вспомогательного резервуара под давлением p и вносится
катализатор. Затем при сохранении неподвижным поршня в реакционном сосуде,
путем синхронного перемещения четырех поршней в хемостатах в реакционный объем
постепенно вводятся количества исходных компонентов 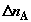 и и 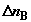 , и соответственно отводятся
образующиеся из них количества продуктов реакции , и соответственно отводятся
образующиеся из них количества продуктов реакции 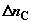 и и 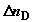 . При этом в хемостатах постоянно
поддерживаются равновесные давления индивидуальных компонентов . При этом в хемостатах постоянно
поддерживаются равновесные давления индивидуальных компонентов 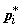 . Необходимо подчеркнуть,
что реакция протекает квазиравновесно, т.к. легко может быть осуществлена и в
противоположном направлении, путем смены направлений движения всех поршней.
После завершения химического превращения в реакционном сосуде остается в том же
количестве и составе газовая смесь, загруженная в него в начале стадии; эта
смесь возвращается во вспомогательный резервуар. Заметим, что использование
буферной газовой смеси равновесного состава предусматривается с той целью,
чтобы контрольное химическое превращение протекало в ненулевом реакционном
объеме. . Необходимо подчеркнуть,
что реакция протекает квазиравновесно, т.к. легко может быть осуществлена и в
противоположном направлении, путем смены направлений движения всех поршней.
После завершения химического превращения в реакционном сосуде остается в том же
количестве и составе газовая смесь, загруженная в него в начале стадии; эта
смесь возвращается во вспомогательный резервуар. Заметим, что использование
буферной газовой смеси равновесного состава предусматривается с той целью,
чтобы контрольное химическое превращение протекало в ненулевом реакционном
объеме.
Последняя стадия – равновесное смешение индивидуальных газов, находящихся в
хемостатах, с итоговым получением в реакционном объеме газовой смеси заданного
состава.
Рассмотрим термодинамические эффекты каждой стадии. На первой и четвертой
стадиях разделения и смешения компонентов через мембраны изменение энтропии
системы не происходит, что обусловлено отсутствием тепловых эффектов этих
процессов (см. предыдущий раздел).
Изменение энтропии при изотермическом расширении (сжатии) индивидуальных
газов на второй стадии в сумме составит (также см. предыдущий раздел)
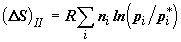 . (2.20) . (2.20)
На этой стадии системой будет произведена работа
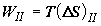 . (2.21) . (2.21)
Более детально остановимся на третьей стадии процесса. Поскольку внутренняя
энергия системы при мембранном (равновесном) разделении и смешении идеальных
газов, а также при их изотермическом расширении или сжатии, остается
постоянной, изменение внутренней энергии на третьей стадии соответствует
полному изменению внутренней энергии системы при переходе ее из начального в
конечное состояние, 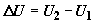 . С другой стороны, работа по перемещению поршней в хемостатах
при постоянном давлении на поршень, равном . С другой стороны, работа по перемещению поршней в хемостатах
при постоянном давлении на поршень, равном 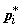 , в сумме составит , в сумме составит
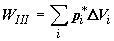 , ,
где 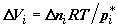 –
изменение объема i-го компонента в хемостате. Таким образом, с
учетом (2.15) –
изменение объема i-го компонента в хемостате. Таким образом, с
учетом (2.15)
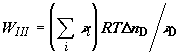 . .
По закону сохранения энергии к системе должно быть подведено от термостата
количество теплоты, равное
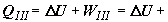 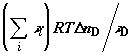 , ,
что в точности соответствует изменению энтальпии при неравновесном
осуществлении химического превращения (2. 19). Отсюда ясно, что изменение
энтропии на третьей стадии равновесного процесса точно равно обратимой
составляющей изменения энтропии в неравновесном процессе.
Складывая (2.18) и (2. 20), получим суммарное изменение энтропии в
равновесном процессе
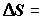 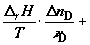 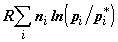 . (2.22) . (2.22)
Второе слагаемое (2.22) определяет искомую величину производства энтропии
при самопроизвольном протекании химического превращения
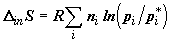 . (2.23) . (2.23)
Примечательно, что структура (2. 23) аналогична структуре выражения для
производства энтропии при смешении газов (2.9).
Отметим, что равновесный переход системы из начального в конечное состояние
сопровождается получением дополнительной работы, равной 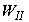 . Эта работа положительна в силу
положительности . Эта работа положительна в силу
положительности 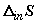 . .
Дифференциальное приращение энтропии при самопроизвольном течении реакции
найдем путем прямого расчета дифференциального изменения функции Гиббса. Так
как 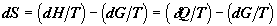 , то , то
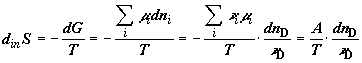 , (2.24) , (2.24)
где 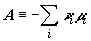 –
химическое сродство реагирующих веществ (менее архаичным и более точным
эквивалентом английскому affinity был бы термин "химическое
притяжение"). Так же, как и формула (2.13) для самопроизвольного смешения
веществ, дифференциальное выражение (2.24) справедливо для
изобарно-изотермического превращения любых смесей (не только идеальных газов). –
химическое сродство реагирующих веществ (менее архаичным и более точным
эквивалентом английскому affinity был бы термин "химическое
притяжение"). Так же, как и формула (2.13) для самопроизвольного смешения
веществ, дифференциальное выражение (2.24) справедливо для
изобарно-изотермического превращения любых смесей (не только идеальных газов).
|


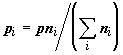 , где i = A, B,C и D .
, где i = A, B,C и D . 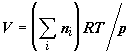 . Первоначальный состав смеси не соответствует химическому
равновесию в системе. После инициирования химической реакции (например, внесением
катализатора) происходит самопроизвольное изменение состава смеси вплоть до
достижения химического равновесия, соответствующего заданным p и
T. Обозначим равновесные давления компонентов через
. Первоначальный состав смеси не соответствует химическому
равновесию в системе. После инициирования химической реакции (например, внесением
катализатора) происходит самопроизвольное изменение состава смеси вплоть до
достижения химического равновесия, соответствующего заданным p и
T. Обозначим равновесные давления компонентов через 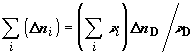 , (2.15)
, (2.15)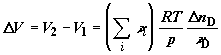 . (2.16)
. (2.16)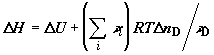 . (2.19)
. (2.19)
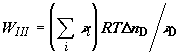 .
.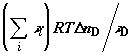 ,
,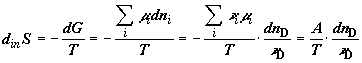 , (2.24)
, (2.24)