Медь и её соединения
Трихлорид тримеди
Cu3Cl3(г). Термодинамические свойства
трихлорида тримеди в стандартном состоянии в интервале температур 100 - 6000 K
приведены в табл. Cu3Cl3.
Молекулярные постоянные, использованные для расчета термодинамических
функций Cu3Cl3,
приведены в табл. Cu.13. Электронографическое исследование [57WON/SCH] и
анализ инфракрасных спектров [72CES/COF, 80MAR/SCH, 84VAN/DEV] показали, что молекула Cu3Cl3 в
основном электронном состоянии имеет конфигурацию неправильного шестичленного
кольца из чередующихся атомов меди и хлора (точечная группа симметрии D3h). Аналогичная структура была
найдена для Cu3I3 (см.
ниже) в электронографическом исследовании [79БУТ]. Результаты теоретических
расчетов [75BAE/MAC, 81ITO, 86LIN/WU] также не противоречат конфигурации симметрии D3h. Произведение главных моментов
инерции (см. табл. Cu.13.) вычислены с использованием параметров, измеренных
Вонгом и Шомакером [57WON/SCH] визуальным методом газовой электронографии: r(Cu-Cl) = 2.16 ± 0.02 Å,
ÐCl-Cu-Cl = 150 ± 10° и ÐCu-Cl-Cu = 90 ± 10°. Хотя величины углов
этим методом не определяются точно [57WON/SCH],
экспериментальное значение ÐCu-Cl-Cu близко
к значению 88.3o, рассчитанному полуэмпирическим методом в работе [86LIN/WU].
Погрешность рассчитанного значения IAIBICсоставляет
5·10‑112 г3·см6.
Из-за сложного состава пара над CuCl, экспериментальные данные о
частотах колебательного спектра Cu3Cl3
неполны и противоречивы. Колебательный спектр Cu3Cl3
исследовался только методом инфракрасной спектроскопии [57KLE/RIC, 72CES/COF, 80MAR/SCH, 84VAN/DEV],
которым можно наблюдать лишь активные в ИК спектре валентные частоты n5 (E¢) и n6 (E¢), а
также деформационные частоты n4 (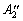 ) и n7 (E¢).
Приведенные в табл. Cu.13. значения этих четырех частот определены в работе
Мартина и Шабера [80MAR/SCH] в инфракрасном спектре поглощения паров CuCl,
изолированных в Ar матрице. Этими авторами был определен состав пара
квадрупольным масс-спектрометром, использован разный состав в матрице,
исследован эффект влияния нагрева и охлаждения матрицы, а также выполнены
расчеты на базе ионной модели. Поэтому отнесение Мартиным и Шабером [80MAR/SCH]
наблюдаемых частот к молекуле CuCl и полимерным формам (CuCl)n
по-видимому более надежно. Цезаро и др. [72CES/COF] также
исследовали инфракрасный спектр паров CuCl, изолированных в аргонной
матрице, однако без определения состава пара и нагрева матрицы. Предполагая,
что количество Cu3Cl3 и Cu4Cl4 в паре
одинаково, авторы [72CES/COF] отнесли полосы 393.5, 285 и 101 см‑1
к n5, n6 и n7
молекулы Cu3Cl3
соответственно. Четыре активных в ИК спектре частоты по оценке были ниже 100 см‑1.
Наиболее противоречивые выводы были сделаны относительно n6. Ван
Лир и Де Вор [84VAN/DEV] исследовали инфракрасный спектр испускания в
микроволновом разряде в смеси кислорода и CuCl2·2H2O. Никаких
полос вблизи 285 см‑1 ими не наблюдалось, и только полоса 396
см‑1 была отнесена к Cu3Cl3.
Клемперер с сотр. [57KLE/RIC] наблюдали широкую полосу с центром при 350 см‑1
в инфракрасном спектре пара равновесного с жидким CuCl при
1200 - 1300 K. Хотя авторы [57KLE/RIC] не
определили состав пара, они отнесли эту полосу к одной из валентных частот (или
к обеим) молекулы Cu3Cl3.
Значения неактивных в инфракрасном спектре частот, n1 - n3 (
) и n7 (E¢).
Приведенные в табл. Cu.13. значения этих четырех частот определены в работе
Мартина и Шабера [80MAR/SCH] в инфракрасном спектре поглощения паров CuCl,
изолированных в Ar матрице. Этими авторами был определен состав пара
квадрупольным масс-спектрометром, использован разный состав в матрице,
исследован эффект влияния нагрева и охлаждения матрицы, а также выполнены
расчеты на базе ионной модели. Поэтому отнесение Мартиным и Шабером [80MAR/SCH]
наблюдаемых частот к молекуле CuCl и полимерным формам (CuCl)n
по-видимому более надежно. Цезаро и др. [72CES/COF] также
исследовали инфракрасный спектр паров CuCl, изолированных в аргонной
матрице, однако без определения состава пара и нагрева матрицы. Предполагая,
что количество Cu3Cl3 и Cu4Cl4 в паре
одинаково, авторы [72CES/COF] отнесли полосы 393.5, 285 и 101 см‑1
к n5, n6 и n7
молекулы Cu3Cl3
соответственно. Четыре активных в ИК спектре частоты по оценке были ниже 100 см‑1.
Наиболее противоречивые выводы были сделаны относительно n6. Ван
Лир и Де Вор [84VAN/DEV] исследовали инфракрасный спектр испускания в
микроволновом разряде в смеси кислорода и CuCl2·2H2O. Никаких
полос вблизи 285 см‑1 ими не наблюдалось, и только полоса 396
см‑1 была отнесена к Cu3Cl3.
Клемперер с сотр. [57KLE/RIC] наблюдали широкую полосу с центром при 350 см‑1
в инфракрасном спектре пара равновесного с жидким CuCl при
1200 - 1300 K. Хотя авторы [57KLE/RIC] не
определили состав пара, они отнесли эту полосу к одной из валентных частот (или
к обеим) молекулы Cu3Cl3.
Значения неактивных в инфракрасном спектре частот, n1 - n3 (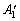 ) и n8 (E²),
приведенных в табл. Cu.13., были оценены по сравнению с частотами тримеров
галогенидов щелочных металлов с учетом
принятых значений n4 - n7.
Погрешность колебательных частот равна 15 см‑1 для n4 - n7 и
около 20% для остальных.
) и n8 (E²),
приведенных в табл. Cu.13., были оценены по сравнению с частотами тримеров
галогенидов щелочных металлов с учетом
принятых значений n4 - n7.
Погрешность колебательных частот равна 15 см‑1 для n4 - n7 и
около 20% для остальных.
По аналогии с тримерами щелочных металлов, статистический вес основного
состояния Cu3Cl3 принят
равным 1. В соответствии с результатом расчета [81ITO],
возбужденные электронные состояния Cu3Cl3 имеют
энергии больше 40000 см‑1, поэтому они не учитывались при
расчете термодинамических функций.
Термодинамические функции Cu3Cl3(г)
вычислялись по уравнениям (1.3) - (1.6), (1.9), (1.10),
(1.122) - (1.124), (1.128) и (1.130) в приближении "жесткий
ротатор – гармонический осциллятор". Погрешность в рассчитанных
значениях термодинамических функций обусловлена ошибками принятых значений
молекулярных постоянных и приближенным методом расчета.Суммарная погрешность равна 10, 15, 20 и 25 Дж×К‑1×моль‑1
для Φ°(T) при T = 298.15, 1000, 3000
и 6000 K
соответственно.
Ранее термодинамические функции Cu3Cl3(г)
были рассчитаны в справочнике JANAF [71STU/PRO] до
6000 K.
Вследствие различия в оценках частот, значения Fo(T), приведенные в [71STU/PRO],
отличаются от принятых (см. табл. Cu3Cl3) на
6 - 9 Дж×К‑1×моль‑1.
Константа равновесия реакции Cu3Cl3(г) = 3Cu(г) + 3Cl(г) вычислена по значению DrH°(0) = 1627.281 ± 12 кДж×моль‑1,
соответствующему принятой энтальпии образования:
DfH°(Cu3Cl3, г, 0) = -258 ± 10 кДж×моль‑1.
Это
значение соответствует значению энтальпии сублимации 3CuCl(к) в форме Cu3Cl3(г), равному
DrH°(0) = 158 ± 8 кДж×моль‑1.
Масс-спектрометрические
измерения Гуидо и др., [71GUI/BAL] показали, что пар над CuCl(к) состоит из Cu3Cl3, Cu4Cl4 и небольшого (несколько
процентов) количества Cu5Cl5. Обработка представленных в работе давлений пара Cu3Cl3(г) (599 - 686.5 K, 8 измерений) приводит к значениям энтальпии сублимации,
равным 162 ± 8 (II закон) и 155.6 ± 8 (III закон) кДж×моль‑1.
Результаты эффузионных и торзионных измерений, обработанные с использованием III закона термодинамики и соотношения P(Cu4Cl4) / P(Cu3Cl3) = 0.6 (заимствовано из [71GUI/BAL]), приводят к величинам DsH°(0) = 159.2 ± 8 кДж×моль‑1 (Шелтон,
548-657К, 15 измерений [61SHE]) и 159.0 ± 8 кДж×моль‑1 (Хаммер и
Грегори, 500-620К, приведено уравнение [64HAM/GRE]). Принято среднее значение по
результатам 3 рассмотренных работ. Погрешность связана с неточностью
термодинамических функций Cu3Cl3. Большие погрешности термодинамических функций полимеров CuCl(г) не позволяют выполнить однозначную интерпретацию
данных по давлению пара при более высоких температурах [22WAR/BOS, 25MAI, 35TAP/KOЖ, 50BRE/LOF, 61ФЕД/ШАХ, 71MIE, 77KRA/OPP, 79ПОЛ/ПОЛ, 87ПИЛ/ЦЕМ]. Обработка этих результатов в предположении присутствия в паре только Cu3Cl3 приводит к величинам в интервале
150 - 158 кДж×моль‑1 .
Принятые
в данном издании термодинамические величины соответствуют давлениям пара в ряду
CuCl-Cu4Cl4, равным 5.0Е-04; 5.0Е-05;
4.0Е-02 и 1.0Е-02 атм при Т = 1100 К и 3.0Е-02; 3.0Е-03; 2.0Е-01 и 4.0Е-02 атм при Т = 1400 К. Эти величины
соответствуют средним степеням полимеризации пара, равным 3.21 и 2.93,
сравнительно с экспериментальными значениями 3.58 (T = 1200 K, [76ПОЛ/НАЗ]) и 2.17 (Т = 1400 К, [22WAR/BOS]).
Авторы:
Ежов Ю.С. ezhovyus@mail.ru
Гусаров А.В. a-gusarov@yandex.ru
Версия для печати