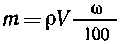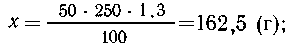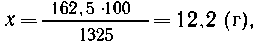Сорокин В.В.,
Загорский В.В., Свитанько И.В.Задачи химических
олимпиад.
1.3.Растворы
При решении задач, связанных с определением
концентрации растворов, используется понятие о
массовой или мольной доле растворенного
вещества в растворе.
Массовая доля растворенного вещества - это
безразмерная физическая величина, равная
отношению массы растворенного вещества к обшей
массе раствора, т. е.
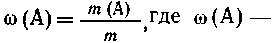 массовая доля
растворенного вещества А,m(А)-масса
растворенного вещества А и т - общая масса
раствора.
массовая доля
растворенного вещества А,m(А)-масса
растворенного вещества А и т - общая масса
раствора.
Массовую долю  (А) можно выражать в долях
единицы или в процентах (проценты - это не
размерность!). Если массовая доля соляной кислоты
равна 0,08 (8%), это означает, что в растворе соляной
кислоты массой 100 г содержится НС1 массой 8 г и
вода массой 100 - 8 = 92 (г).
(А) можно выражать в долях
единицы или в процентах (проценты - это не
размерность!). Если массовая доля соляной кислоты
равна 0,08 (8%), это означает, что в растворе соляной
кислоты массой 100 г содержится НС1 массой 8 г и
вода массой 100 - 8 = 92 (г).
Важнейшей концентрацией, используемой в
химической практике, является молярная
концентрация раствора. Молярная концентрация,
или молярность, - это величина, равная отношению
количества растворенного вещества (моль) к
объему раствора, выраженному в литрах. Основной
единицей молярной концентрации является моль/л.
Раствор, в 1 л которого содержится 1 моль
растворенного вещества, называется
одномолярным.
Пример 1. 500 мл раствора содержат 20 г NaOH.
Найдите молярную концентрацию раствора.
Решение. M(NaOH) = 40 г/моль; 20 г NaOH составляет 20/40 = 0,5
(моль) NaOH. Далее составляем пропорцию:
| в 500 мл раствора содержится 0,5 моль NaOH, |
| в 1000 мл -"- -"- -"---"----"----"
х моль NaOH, |
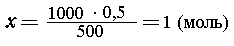 |
т. е. концентрация раствора 1 моль/л (или 1М).
Пример 2. Кристаллогидрат CoCl2.6H2O
массой 476 г растворили в воде, при этом массовая
доля хлорида кобальта(II) в растворе оказалась
равной 13,15%. Рассчитайте массу воды, взятую для
растворения кристаллогидрата.
Решение. M(CoCl2) = 130; М(СоСl2.6Н2О)
=238, т. е. 476 г. СоСl2.6Н2О
составляют 2 моль, в растворе, соответственно,
будет находиться 2 моль СоСl2 (2.130 = 260
г).
| В растворе массой 100 г
содержится 13,15 г СоСl2, |
| -"--"- -"---"------"--- х г
-----"---"------" 260 г СоСl2, |
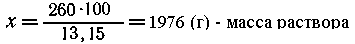 |
следовательно, масса воды, взятая для
растворения кристаллогидрата, равна 1976 - 476 (масса
кристаллогидрата) = 1500 (г).
Пример 3. Для приготовления раствора
взяли навеску вещества массой тг и воду.
После растворения получен раствор объемом Vсм3,
плотностью р г/см3. Предложите формулу для
расчета в общем виде массовой доли исходного
вещества в полученном растворе  %. Во всех ли случаях
пригодна такая формула? Приведите примеры
веществ, при растворении которых в воде можно
использовать эту формулу, и примеры веществ, для
которых этой формулой пользоваться нельзя.
%. Во всех ли случаях
пригодна такая формула? Приведите примеры
веществ, при растворении которых в воде можно
использовать эту формулу, и примеры веществ, для
которых этой формулой пользоваться нельзя.
Решение. Формула для расчета массовой доли
вещества в растворе имеет вид
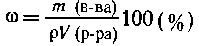
Эту формулу можно использовать для расчета
массовой доли в растворе, например, таких
веществ, как NaCl, K2SO4 и др. Формула не
пригодна для веществ, которые при растворении в
воде с ней химически взаимодействуют. Так, при
растворении натрия в воде происходит реакция
2Na + 2Н2О = 2NaOH + Н2.
Масса раствора при этом уменьшается за счет
выделения водорода; в растворе находится не
исходный металл, а его гидроксид - NaOH.
Задачи
1. Сколько (г) необходимо взять СоСl2 6Н2О и
воды для приготовления 180 г раствора хлорида
кобальта с массовой долей 5%?
6Н2О и
воды для приготовления 180 г раствора хлорида
кобальта с массовой долей 5%?
2. Растворимость Na2CO3 при
температуре 20oС равна 21,8 г в 100 г. воды. Чему
равна массовая доля вещества (%) в насыщенном
растворе?
3. В воде растворили 5 г медного
купороса CuSO4.5H2O и довели объем
раствора до 500 см3. Какое количество
сульфата меди содержится в полученном растворе?
4. При растворении 5,38 г
кристаллогидрата сульфата цинка ZnSO4.
xH2O в 92 см3 воды получен раствор с
массовой долей сульфата цинка 0,0331. Установите
состав кристаллогидрата (величину х).
5. Химическим анализом было
установлено, что в кристаллогидрате, полученном
кристаллизацией хлорида лития из раствора,
содержится 7,19% лития. Какова формула этого
кристаллогидрата?
6. Сколько граммов кристаллогидрата FeSO4 7Н2О
необходимо взять для приготовления 10 кг раствора
сульфата железа (II) с массовой долей вещества 5%?
7Н2О
необходимо взять для приготовления 10 кг раствора
сульфата железа (II) с массовой долей вещества 5%?
7. Сколько граммов хлорида натрия
нужно растворить в 100 г 15,5% раствора NaCl, чтобы его
концентрация стала равной 17,5%?
8. Определить, сколько граммов 10%-го
раствора оксида серы(VI) в чистой серной кислоте и
60%-го раствора серной кислоты необходимо для
приготовления 480 г 90%-го раствора кислоты.
9. Водный раствор объемом V см3 и
плотностью р г/см3 с массовой долей
растворенного вещества  (%) упарили до выделения всего
растворенного вещества в безводной форме.
Предложите формулу для расчета в общем виде
массы выделившегося вещества m г. Подтвердите
правильность формулы расчетами.
(%) упарили до выделения всего
растворенного вещества в безводной форме.
Предложите формулу для расчета в общем виде
массы выделившегося вещества m г. Подтвердите
правильность формулы расчетами.
10. Смешали 1 л воды с 250 см3 раствора
азотной кислоты (массовая доля 50%, плотность 1,3
г/см3). Какова массовая доля кислоты (%) в
полученном таким образом растворе?
11. Какую навеску твердого гидроксида натрия
необходимо взять для приготовления 50 см3
раствора с концентрацией 0,15 моль/л?
12. Чему равна молярная концентрация раствора,
содержащего 4,0 г гидроксида натрия в 2 л раствора?
13. Чему равна масса воды, которую необходимо
прилить к 200 г раствора гидроксида натрия с
массовой долей 30% для приготовления раствора
гидроксида натрия с массовой долей 6%?
14. Какая масса (г) алюмокалиевых квасцов KA1(SO4)2.12Н2О
выкристаллизуется из 320 г насыщенного при 20oС
раствора KA1(SO4)2, если испарить 160 г
воды из этого раствора при 20oС? (Насыщенный
при 20oС раствор содержит 5,50% KA1(SO4)2
по массе.)
Решения
1. Масса безводной соли в 180 г 5%-го раствора
равна: m = 180.0,05 = 9 (г); СоСl2.6Н2О:
М(СоСl2) = 129 г/моль; 6.М(Н2О) =6.18
г/моль.
| 9 г- 129 г/моль, |
х г - 6 18
г/моль, 18
г/моль, |
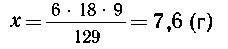
(где х-масса воды в кристаллогидрате). Отсюда
требуемая масса кристаллогидрата соли равна 9 +
7,6=16,6 (г), а требуемая масса воды равна 180-16,6=163,4 (г).
2. В насыщенном растворе на 100 г воды приходится
21,8 г Na2CO3, таким образом,
121,8 г раствора содержит 21,8 г Na2CO3,
100 г -"- -"---"----"------"---" х г Na2CO3, |
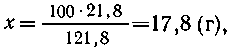
т. е.  (Na2CO3) в растворе равна 17,8%.
(Na2CO3) в растворе равна 17,8%.
3. M(CuSO4.5H2O) =249,7 г/моль; в
полученном растворе содержится: 5/249,7 = 0,02 (моль)
соли.
4. Масса раствора, полученного при растворении
кристаллогидрата, составляет 92+5,38 = 97,38 (г).
Масса ZnSO4 равна 97,38/0,0331 = 3,23 (г); M(ZnSO4) =
161,4 г/моль.
Находим молярную массу ZnSO4. xH2O
3,23 г- 161,4 г/моль
5,38 г - х г/моль
х = 269,4 г/моль. |
M(ZnSO4 . xH2O) =269,4 г/моль; масса
"x" моль Н2О равна 269,4- 161,4=108 (г).
Количество воды в кристаллогидрате равно 108/18 = 6
(моль), следовательно, состав кристаллогидрата ZnSO4.6H2O.
5. Mr(LiCl) = 42,4; Ar(Li) = 6,9; х - число молей Н2О
в моле кристаллогидрата.
| 7,19% соответствуют 6,9 г, |
| 100% -"- --"----"----"--" (4,24+18х)г, |
х = 3. |
Формула вещества LiCl.3H2O
6. Mr(FeSO4) = 152; Mr(FeSO4 .7H2O)
=278.
5 г FeSO4 должно содержаться в 100 г
раствора,
х г FeSO4-"- -"- --"---'----"------" в 10000 г
-"- , |
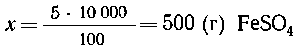
В 278 г кристаллогидрата содержится 152 г FeSO4
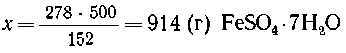
7. В 100 г 15,5%-го раствора содержится 15,5 г соли и 84,5
г воды. Пусть растворили х г соли, тогда ее масса в
растворе станет (15,5 + х) г, а концентрация
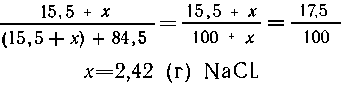
8. В 100 г 10%-го олеума содержится 10 г SO3 и 90 г
100%-й серной кислоты. Если пересчитать содержание
SO3, то в 90 г H2SO4 условно
содержится всего (18/98)-90 = 16,53 (г) воды, остальные 100 -
16,53 = 83,47 (г) в олеуме составляет SO3.
Аналогично в случае 60%-и серной кислоты: 40 + 60  ( 18/98) = 11,02 + 40 =
51,02 (г) воды и 48,98 (г) SO3. В 480 г 90%-и кислоты
содержится 0,9.480 = 432 (г) H2SO4,
или (80/98).432 = 352,65 (г) SO3 и (480 -352,65) = 127,35 (г)
воды. Пусть надо взять х г олеума, тогда 60%-й
кислоты- (480-х) г.
( 18/98) = 11,02 + 40 =
51,02 (г) воды и 48,98 (г) SO3. В 480 г 90%-и кислоты
содержится 0,9.480 = 432 (г) H2SO4,
или (80/98).432 = 352,65 (г) SO3 и (480 -352,65) = 127,35 (г)
воды. Пусть надо взять х г олеума, тогда 60%-й
кислоты- (480-х) г.
В олеуме содержится (х/100) .83,47 (г) SO3, а
в кислоте ---- 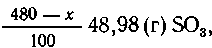 что в сумме составляет 352,65 г SO3.
что в сумме составляет 352,65 г SO3.
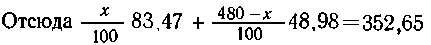 ,
,
решая уравнение, получим x = 340,8 (г) олеума, а
60%-й кислоты соответственно 480-340,8=139,2 (г).
9.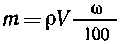
10.
| 50 г НNО3 содержится в растворе массой 100 г, |
| х г НNО3 -"--"- -"- -"---"-----"------"------"250 см3.1,3
г/см3 |
|
х г НNО3 содержит
раствор массой 100 г,
|
| 162,5 г НNО3----"----"----"-----"-----"-----"(1000
+ 325) г, |
|
т. е. массовая доля HNO3 в растворе 12,2%.
11.
| 0,15 моль содержится в 1 л раствора, |
| х -"- -"- --"----"------"--"--в 0,050 л -"- |
x = 0,0075 моль NaOH, M(NaOH) = 40 г/моль,
следовательно, масса навески равна 0,0075  40 = 30 г 40 = 30 г |
12.
| 4,0 г NaOH содержится в 2 л раствора |
| x г NaOH ----"----"----" в 1 л -"-
|
| x = 2,0 г. |
----------------------------------------------------------- |
| 40 г NaOH соответствует 1 моль, |
| 2 г NaOH ----"----"------" х моль, |
| х = 2.1/40 = 0,05 моль в 1 л раствора. |
13.
| В растворе массой 100 г содержится NaOH массой 30 г |
| в -----"------"-------200 г -------"----" NaOH ---"----" x
г |
x = 60г NaOH |
| --------------------------------------------------------------------- |
| NaOH массой 6 г содержится в растворе массой100 г |
| ----"----"----"-"----"60г----"----"------"------"-------"---"х
г |
х = 1000 г |
К исходному раствору необходимо добавить 1000 - 200 = 800 (г) воды.
14. Относительные атомные массы:
Ar(К)=39; Ar(О) = 16; Ar(А1)=27; Ar(Н)
= 1.
а. 5,5 г KAl(SO4)2 соответствует 10,10 г KAl(SO4)2 12Н2О
(так как 258 г KAl(SO4)2 соответствует 474 г
KAl(SO4)2
12Н2О
(так как 258 г KAl(SO4)2 соответствует 474 г
KAl(SO4)2 12H2O). В насыщенном растворе
содержится:
12H2O). В насыщенном растворе
содержится:
(100-10,10) г Н2О-10,10 г KAl(SO4)2 12H2O 12H2O |
| 160г Н2О ----"-----" х г
------"-----"----"-----" |
х= 17,98 г KAl(SO4)2 12H2O 12H2O |
б. Возможный вариант решения. Пусть х - масса
выкристаллизовавшихся квасцов, а у - масса
насыщенного раствора KA1(SO4)2, которая
останется после кристаллизации. Массовая доля
KA1(SO4)2 в кристаллогидрате составляет
0,544. Тогда:
320 = x + y + 160, y = 160 - х;
320 • 0,055 = x • 0,544 + (160-x) • 0,055;
х= 17,99 г.

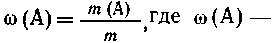 массовая доля
растворенного вещества А,m(А)-масса
растворенного вещества А и т - общая масса
раствора.
массовая доля
растворенного вещества А,m(А)-масса
растворенного вещества А и т - общая масса
раствора.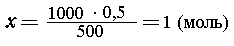
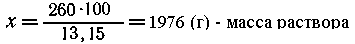
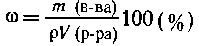
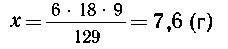
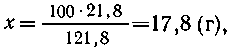
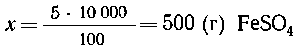
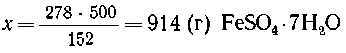
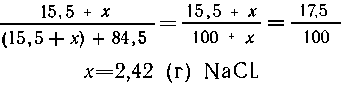
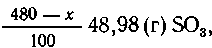 что в сумме составляет 352,65 г SO3.
что в сумме составляет 352,65 г SO3.
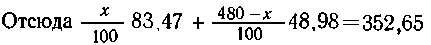 ,
,