Сорокин В.В.,
Загорский В.В., Свитанько И.В.Задачи химических
олимпиад.
§ 2.Решение задач с составлением одной пропорции
Прежде всего, прочитав условие задачи, следует
составить схемы уравнений всех химических
реакций, о которых идет речь в условии. Затем
схемы реакций надо превратить в уравнения, найдя
стехиометрические коэффициенты. Проделав эти
предварительные операции, можно искать подход к
решению задачи.
В условии задачи, как правило, указывают на
необходимость нахождения массы (или количества
молей) известного вещества, получаемого либо
расходуемого в результате химических реакций.
Рекомендуется вне зависимости от сложности
предлагаемой задачи неизвестную величину (масса,
количество молей) обозначать как х.
Следует по мере возможности воздерживаться от
введения любых дополнительных или промежуточных
неизвестных, вычисление которых не требуется в
условии задачи. Необходимо стараться свести
решение задачи к составлению одного пропорционального
соотношения, даже если по условию задачи
существует целая "цепочка" превращений. В
этом помогает так называемый метод
стехиометрических схем, суть которого
становится ясной из приводимых ниже примеров.
В общем случае условие задачи, тип которой
рассматривается в настоящем параграфе,
формулируется следующим образом: "Имеется
химическое превращение заданных известных
веществ (или несколько химических превращений).
Дана масса (количество) одного из исходных
веществ, причем обязательно указывается или
подразумевается, что второе вещество находится в
избытке. Требуется определить массу (количество)
одного из продуктов".
Перечислим последовательность операций,
которые необходимо проделать для решения
сформулированной подобным образом задачи.
1. Составить уравнение всех упомянутых в
условии задачи реакций.
2. Обозначить через неизвестное х параметр,
который подлежит определению.
3. Провести анализ на достаточность данных, т. е.
установить, достаточно ли данных для нахождения
неизвестного параметра, а также на предмет
определения тех данных задачи, по которым
находится (вычисляется) неизвестное.
4. Использовать алгоритм вычисления неизвестного
х, который заключается в:
а) расчете молярных масс соединений М (г/моль);
б) составлении пропорций;
в) решении составленной пропорции относительно
неизвестного х
г) анализе и записи ответа, проверке его
качественного и количественного соответствия
вопросу задачи.
2.1. Простейшая пропорция: количественные данные
заданы в явном виде
Приведенный выше алгоритм представляет
собой задачу на простейшую пропорцию. Составим
уравнение реакции:
aA+bB = cC + dD,
где а, Ь, с, d - коэффициенты в уравнении
реакции; А и В - известные исходные вещества; С и D -
продукты, которые либо могут быть известными,
либо их формулы необходимо написать
самостоятельно.
Пусть задано количество вещества A ( моль); вещество В - в
избытке. Требуется найти количество С. Решается
такая задача просто:
моль); вещество В - в
избытке. Требуется найти количество С. Решается
такая задача просто:
| из а моль А получается с моль
С, |
из  моль А --- "---" ---" х моль
С, моль А --- "---" ---" х моль
С, |
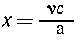
|
Расчет в молях проще расчета в граммах, в чем
легко убедиться, решив задачу следующего
содержания.
Задана масса вещества А - т (А.), а вещество
В в избытке. Требуется найти массу продукта
реакции- вещества С, т. е. т (С).
Составим пропорцию:
| из а М(А) образуется с
М(С), |
| из m (А) --- "---"-- -" m
(C) |
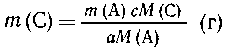 |
Далее рассмотрим два возможных варианта
приведенной задачи.
Вариант I. Известен объем У (А)
газообразного А, необходимо определить т (С)-массу
С.
Из a  22,4 л А получается с М(С) г С, 22,4 л А получается с М(С) г С, |
| из V (А) л А --- "---"---"---" т
(С) г С, |
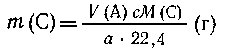 |
Вариант II. Известен объем V (А)
газообразного А, необходимо определить объем V(C)
газообразного С.
Из а  22,4 л А получается с 22,4 л С, 22,4 л А получается с 22,4 л С, |
| из V(А) л А ---- "---"---- "-- V(C) л
С, |
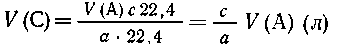 |
Естественно, все приведенные
пропорции пригодны для решения задач, в которых
известно количество продукта, а нужно определить
количество исходного реагента (можно по тем же
формулам), представив в качестве неизвестного  (A), m(A) или V(А)
(вместо
(A), m(A) или V(А)
(вместо  (C),
m(C) и V(C) соответственно) При решении любой
задачи следует также помнить, что везде, где
только это возможно, решать задачу нужно в молях.
В большинстве задач, и Вы в этом неоднократно
убеждались и сможете убедиться в будущем,
заданные значения массы веществ кратны их
молярным массам. Решение в молях упрощает
расчеты и уберегает от многих арифметических
ошибок.
(C),
m(C) и V(C) соответственно) При решении любой
задачи следует также помнить, что везде, где
только это возможно, решать задачу нужно в молях.
В большинстве задач, и Вы в этом неоднократно
убеждались и сможете убедиться в будущем,
заданные значения массы веществ кратны их
молярным массам. Решение в молях упрощает
расчеты и уберегает от многих арифметических
ошибок.
Пример 1. Определить массу гидроксида
натрия, необходимого для реакции с 9,4 г фенола.
Решение. Уравнение реакции:
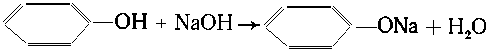 |
| М(С6Н5ОН) = 94 г/моль;
M(NaOH) = 40 г/моль. |
| С 94 г фенола реагирует 40 г NaOH, |
| с 9,4 г --- "---- "-----"----" х г
NaOH, |
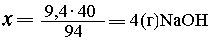
|
Решение (в молях). 9,4 г фенола
соответствует 0,1 моль. С 1 моль фенола реагирует 1
моль щелочи, а с 0,1 соответственно 0,1 моль щелочи,
т. е. 0,1 40 = 4
(г). В данном конкретном случае практически не
имеет значения, решать задачу в граммах или в
молях.
40 = 4
(г). В данном конкретном случае практически не
имеет значения, решать задачу в граммах или в
молях.
Пример 2. Какую массу (г) алюминия нужно
ввести в реакцию с 7,6 г оксида хрома(III), чтобы
получить чистый хром?
Решение. Уравнение реакции:
| 2Аl + Сr2О3 = Аl2О3+
2Сr. |
Для реакции с 152 г Сr2О3
требуется 2 27
г А1, 27
г А1, |
| для - "------- " - 7,6 г Сr2О3
---"---"---" - х г А1, |
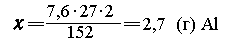
|
Решение (в молях). 7,6 г Сr2О3 - это 0,05
(7,6/152) моль; на 1 моль Сr2О3 требуется 2
моль Аl; на 0,05 моль Сr203 - 2 0,05 = 0,1 моль Аl (или 2,7 г).
0,05 = 0,1 моль Аl (или 2,7 г).
Пример 3. Воздух (объемом 1 л) с примесью
хлора пропустили через избыток раствора йодида
калия, при этом выделилось 0,127 г йода. Определить
объемную долю хлора в данной газовой смеси.
Решение
Уравнение реакций:
О2+КI  не реагирует в данных условиях,
не реагирует в данных условиях,
Сl2+2КI = 2КСl + I2.
| 254 г йода выделяется при реакции с
22,4 л Сl2, |
| 0,127 г --- "----
"----"------"----------"-- х л Сl2, |
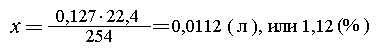 |
Вот конкретный пример пользы от решения в
молях: 0,127 г I2 - это 0,0005 моль I2. Такое же
количество Сl2 (0,0005 моль) занимает объем 0,0005 22,4 = 0,0112 (л).
Объемная доля хлора в данном образце воздуха
равна 0,0112/1 = 0,0112, или 1,12 (%).
22,4 = 0,0112 (л).
Объемная доля хлора в данном образце воздуха
равна 0,0112/1 = 0,0112, или 1,12 (%).
Задачи
1. Какое количество натрия необходимо
добавить к 1 л воды, чтобы образовался раствор
гидроксида натрия с массовой долей вещества 1%?
Плотность воды принять равной 1 г/см3.
2. Сколько выпадает осадка при
прибавлении раствора, содержащего 16,4 г нитрата
кальция, к избытку раствора соды (карбоната
натрия)?
3. Над раскаленным оксидом меди
пропустили избыток водорода. Затем образец
охладили и взвесили. Во сколько раз изменилась
его масса?
4. A г оксида кальция внесли в В мл воды
и получили прозрачный раствор. Вычислите
массовую долю вещества в полученном растворе.
5. Смесь водорода и хлора в закрытом
сосуде при постоянной температуре облучали
рассеянным светом. Через некоторое время
содержание хлора уменьшилось на 20% по сравнению с
исходным, а объемные доли компонента смеси в этот
момент стали следующими: 60% хлора, 10% водорода и 30%
хлороводорода. Каким был количественный состав
исходной смеси газов? Как получают хлор, водород,
хлороводород?
6. Какой объем воздуха (объемная доля
кислорода 21%) необходим для полного сгорания 1 л
сероводорода? Какая масса 4%-го раствора
гидроксида натрия потребуется для поглощения
продуктов сгорания? Объемы газов измерены при
нормальных условиях.
7. Сульфат калия массой 20 г растворили
в 150 мл воды и провели электролиз раствора. После
электролиза массовая доля сульфата калия
составила 15%. Какие объемы водорода и кислорода
были получены при температуре 20oС и
давлении 101325 Па?
8. Как изменится давление к моменту
наступления равновесия реакции синтеза аммиака,
протекающей в закрытом сосуде при постоянной
температуре, если начальные концентрации азота и
водорода а смеси равны соответственно 2 и 6 моль/л
и равновесие наступает, когда прореагировало 10%
азота.
9. Какую массу (г) металлического цезия
можна получить из 14,2 г цезиевых квасцов (они по
составу подобны калиевым) по приводимому
способу: Н. Бекетов (1894 г.) приготовил цезий из его
алюмината накаливанием с порошком магния, и весь
цезий получился в металлическом виде ... Алюминат
цезия был приготовлен через осаждение цезиевых
квасцов едким баритом через выпаривание
полученного раствора (Д. И. Менделеев "Основы
химии")
Решения
.
1. Составим уравнение реакции:
2Na + 2Н2О = 2NaOH + Н2.
Обозначим искомую массу натрия через х.
Масса 1 л (1000 см3) воды равна 1000 см3  1г/см3=1000
г. Из х г натрия образуется (80/46) х г
гидроксида натрия и (2/46) х т водорода. В
результате масса раствора гидроксида натрия
равна:
1г/см3=1000
г. Из х г натрия образуется (80/46) х г
гидроксида натрия и (2/46) х т водорода. В
результате масса раствора гидроксида натрия
равна:
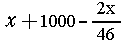
Связывая массы раствора и растворенного
вещества, получаем соотношение
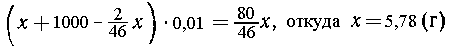
2. Уравнение реакции, приводящей к
образованию осадка:
| Na2CO3 |
+ Ca(NO3)2 |
= CaCO3 |
+ 2NaNO3; |
| Мr |
164 |
100 |
|
|
164 |
100 |
|
|
16,4 г |
х г |
|
| x = 10 (г) осадка карбоната
кальция. |
3. CuO + H2 = Cu + H2O;
| 1 моль - 1 моль, |
| 80 г/моль - 64 г/моль, |
| 80 г СuО дают 64 г Сu. |
Значит, масса взятого образца после
пропускания над ним водорода уменьшается в 80/64=1,25
раз.
4. СаО + Н2О = Са(ОН)2;
| 56 г СаО взаимодействует с
водой с образованием 74 г Са(ОН)2, |
| A г СаО -----"----
"------"-----"-----"-----"-----"-----" 74/56 A г Са
(ОН) 2. |
Таким образом, в растворе будет содержаться 1,32 А
г Са(ОН)2. Так как масса раствора (исходя
из уравнения реакции) равна сумме масс исходных
веществ и составляет (А + В) г, то, считая
вещество полностью растворившимся (нет осадка),
имеем
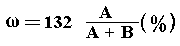
5.
| Н2 |
+ |
Сlа |
= |
2НСl; |
| 1 моль |
|
1 моль |
|
2 моль |
30 объемных частей НС1 получаются при
взаимодействии 15 объемных частей Н2 и 15
объемных частей С12; следовательно, состав
исходной газовой смеси: Сl2 : 60+15 = 75%, Н2
: 10+15 = 25%. Хлор и водород можно получить, например,
электролизом водного раствора хлорида натрия:
NaCl (водн.) = Na+(водн.) + С1- (водн.);
-на аноде: 2С1 - 2ё = С12;
-на катоде: 2Н + 2ё = Н2 (из Н20).
Хлороводород можно получить взаимодействием
водорода с хлором.
6. Уравнение происходящей реакции:
2H2S + 3O2 = 2SO2+2H2O.
Для сгорания 1 л H2S требуется 1,5 л О2
или 1,5/0,21 = 7,15 л воздуха. Выделится 1 л SO2, или
1/22,4 = 0,0447 моль SO2. Для поглощения SO2 по
реакции SO2 + 2NaOH = Na2SO3 + H2O
потребуется 2  0,0447 = 0,0894 моль, или 0,0894
0,0447 = 0,0894 моль, или 0,0894  40 = 3,58 г NaOH. При этом
4%-го раствора NaOH потребуется 3,58/0,04 = 89,4 г.
40 = 3,58 г NaOH. При этом
4%-го раствора NaOH потребуется 3,58/0,04 = 89,4 г.
Для поглощения SO2 по реакции SO2 + NaOH =
NaHSO3 необходимо взять 44,7 г 4%-го раствора NaOH.
7. При электролизе разлагается только
вода, т. е. количество сульфата калия в растворе
не меняется. Соль служит электролитом:
2Н2О = 2Н2 + О2.
Масса воды в растворе:
а) до электролиза m(Н2О) = 150 г;
б) после электролиза m(Н2О) = m(р-ра) - m(K2SO4)
= (20/0,15)-20=113,3 г.
Масса воды, разложившейся при электролизе: m(Н2О)
= 150-113,3 = 36,7 г, т. е.  (H2O)=2,04 моль,
(H2O)=2,04 моль,  (H2)=2,04 моль,
(H2)=2,04 моль,  (O2) = l,02
моль.
(O2) = l,02
моль.
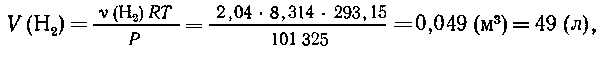
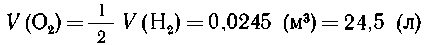
8. N2+3H2 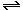 2NH3.
2NH3.
К моменту наступления равновесия
прореагировало 10% N2 или 2  0,1=0,2 моль/л N2 и 0,6
моль/л Н2, всего 0,8 моль/л газов. По уравнению
реакции 4 объема газа дают 2 объема: 0,8 моль/л
0,1=0,2 моль/л N2 и 0,6
моль/л Н2, всего 0,8 моль/л газов. По уравнению
реакции 4 объема газа дают 2 объема: 0,8 моль/л  0,4 моль/л.
0,4 моль/л.
В смеси осталось: 2 + 6 - 0,4 = 7,6 (моль/л) газов. Из
уравнения Менделеева-Клапейрона p = -vRT / V = cRT. Давление
уменьшится в (7,6/8,0) =0,95 раза.
9. Гидроксид бария (едкий барит)
позволяет легко превратить цезиевые квасцы в
гидроксоалюминат:
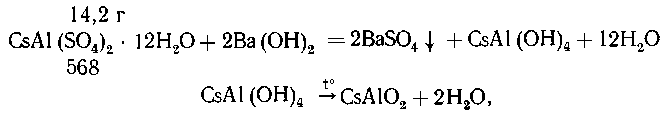
Реакция с магнием приводит к образованию
летучего продукта - металлического цезия, и
равновесие смещается вправо:

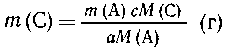
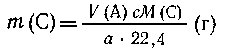
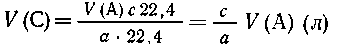
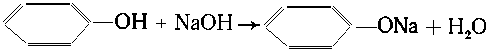
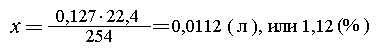
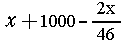
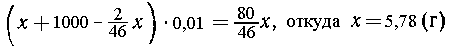
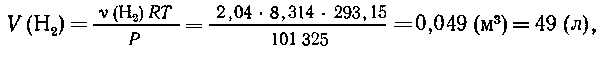
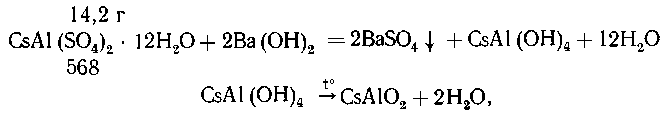
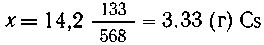 .
.