В предыдущих главах вы познакомились с
составом и строением изолированных атомов
различных элементов, изучили их энергетические
характеристики. Но в окружающей нас природе
изолированные атомы встречаются крайне редко.
Атомы почти всех элементов " стремятся"
соединиться, образуя молекулы или другие более
сложные химические частицы. Принято говорить,
что при этом между атомами возникают химические
связи.
В образовании химических связей участвуют
электроны. Каким образом это происходит, вы
узнаете, изучив эту главу. Но прежде нам надо
ответить на вопрос, почему атомы образуют
химические связи. На этот вопрос мы можем
ответить, даже не зная ничего о природе этих
связей: " Потому что это энергетически
выгодно!" А вот, отвечая на вопрос, откуда при
образовании связей возникает выигрыш в энергии,
мы постараемся понять, как и почему химические
связи образуются.
Как и электронное строение атомов, подробно и
строго научно химические связи изучает
квантовая химия, а мы с вами можем только
воспользоваться некоторыми важнейшими выводами,
сделанными учеными. При этом для описания
химических связей мы будем пользоваться одной из
простейших моделей, предусматривающей
существование трех типов химической связи
(ионной, ковалентной и металлической).
Вспомните – грамотно пользоваться любой
моделью можно, только зная границы применимости
этой модели. Модель, которой мы будем
пользоваться, тоже имеет свои границы
применимости. Например, в рамках этой модели
нельзя описать химические связи в молекулах
кислорода, большинства бороводородов и
некоторых других веществ. Для описания
химических связей в этих веществах используют
более сложные модели.
7.2. Типы химических связей
Причина образования химических связей – выигрыш
в энергии системы связанных атомов по
сравнению с изолированными атомами.
Строение электронных оболочек и энергетические
характеристики разных атомов сильно отличаются.
Неудивительно, что и выигрыш в энергии при
образовании связей между ними разный и
достигается разными способами. Отсюда и разные
типы химических связей между атомами.
Посмотрите на построенный вами график
зависимости энергии ионизации от порядкового
номера элемента. Как видно из этого графика,
энергия ионизации атомов каждого из элементов,
образующих благородные газы (Не, Nе, Ar, Кr и др.),
превышает энергию ионизации атомов элементов
как предыдущего, так и последующего периодов.
Следовательно, атомы благородных газов
совершенно не склонны отдавать свои электроны.
Теперь посмотрите на аналогичный график
зависимости энергии сродства к электрону от
порядкового номера элемента. Как видите, эта
зависимость только в общих чертах соответствует
тем простейшим закономерностям, которые мы
проследили в предыдущей главе. И все же из
графика видно, что у атомов благородных газов
энергия сродства к электрону меньше, чем у
большинства других атомов, кроме того она имеет
отрицательные значения. Следовательно, атомы
элементов, образующих благородные газы,
совершенно не склонны принимать чужие электроны.
Если эти атомы не склонны ни отдавать свои, ни
принимать чужие электроны, то, следовательно, их
электронные оболочки энергетически выгодны, а
потому – особо устойчивы. Это объясняет, почему,
принимая или отдавая электроны, атомы других
элементов " стремятся" приобрести валентную
конфигурацию атомов благородных газов.Так как у
атомов благородных газов на всех валентных
подуровнях находится максимально возможное
число электронов (свободных мест нет)
электронные оболочки атомов благородных газов
часто называют завершенной электронной
оболочкой– ns2np6. Своих
валентных электронов у атома для этого либо
слишком много, либо слишком мало. Какие же у него
есть возможности для приближения своей
электронной оболочки к завершенной?
Первая возможность: отдать другому атому "
лишние" электроны или отнять у другого атома
" недостающие" электроны. И в том, и в другом
случае образуются ионы. Но обратите внимание:
энергия ионизации любого атома больше, чем
энергия сродства к электрону любого другого
атома. За счет чего же происходит передача
электронов от одного атома другому, ведь
затратить нужно больше энергии, чем ее выделится?

Чтобы понять, за счет чего может возникнуть
выигрыш в энергии, рассмотрим систему, состоящую
из двух разноименно заряженных частиц а– и б+
(рис. 7.1). Расстояние между частицами l
(состояние I). Так как разноименно заряженные
частицы притягиваются, то такая система обладает
потенциальной энергией, которая может
выделиться при сближении этих частиц. В
результате система перейдет в состояние II с
меньшей энергией. Именно это и происходит при
образовании химической связи между ионами. Ведь
получившиеся разноименно заряженные ионы
притянутся друг к другу, между ионами возникнет ионная
связь и образуется ионный кристалл.
Выигрыш в энергии при образовании связи
компенсирует затраты на образование ионов.
Если же у атомов близкие склонности отдавать
(или принимать) электроны, то передать электроны
друг другу они не могут, и им остается только
попытаться использовать и свои, и чужие
электроны совместно, не отдавая и не принимая их
полностью. Это – вторая возможность атома
образовать завершенную электронную оболочку. В
этом случае при образовании связи также
компенсируются все энергетические затраты, но
причины здесь более сложные.
Посмотрим, в каких случаях и как атомы
осуществляют эти возможности.
Таблица 16.Примеры
образования ионных соединений
Электронные
формулы
исходных атомов |
Уравнения
передачи
электронов |
Электронные
формулы
образующихся ионов |
Структурная
формула
вещества(*) |
Простейшая
формула
вещества |
| Na – [Ne]3s1 Cl – [Ne]3s23p5 |
Na – e– = Na+ Cl + e– = Cl– |
Na+ – [Ne] Cl– – [Ar] |
(Na )(Cl )(Cl ) ) |
NaCl |
| Ca – [Ar]4s2 Br – [Ar,3d10]4s24p5 |
Ca – 2e– = Ca2+ Br + e– = Br– |
Ca2+ – [Ar] Br– – [Kr] |
(Ca2 )(Br )(Br )2 )2 |
CaBr2 |
| Fe – [Ar]4s23d6 S –
[Ne]3s23p4 |
Fe – 2e– = Fe2+ S + 2e– = S2– |
Fe2+ – [Ar]3d6 S2– –
[Ar] |
(Fe2 )(S2 )(S2 ) ) |
FeS |
*)В структурных формулах веществ с ионными
связями указываются формальные заряды: 
 , 2
, 2 , 2
, 2 и т. д. Что это
такое, и чем эти заряды отличаются от истинных
зарядов (обозначаются без кружочков) вы узнаете,
изучив § 7.6.
и т. д. Что это
такое, и чем эти заряды отличаются от истинных
зарядов (обозначаются без кружочков) вы узнаете,
изучив § 7.6.
1. Если связываемые атомы сильно отличаются по
размерам, то маленькие атомы (склонные принимать
электроны) отнимут электроны у больших атомов
(склонных отдавать электроны), и образуется
ионная связь. Энергия ионного кристалла меньше,
чем энергия изолированных атомов, поэтому ионная
связь возникает даже тогда, когда атому не
удается, отдавая электроны, полностью завершить
свою электронную оболочку (незавершенным может
остаться d- или f-подуровень). Рассмотрим
примеры.
2. Если связываемые атомы маленькие(ro
<1 ),
то все они склонны принимать электроны, а
отдавать их не склонны; поэтому отобрать друг у
друга электроны такие атомы не могут. В этом
случае связь между ними возникает за счет
попарного обобществления неспаренных валентных
электронов: один электрон одного атома и один
электрон другого атома с разными спинами
образуют пару электронов, принадлежащую обоим
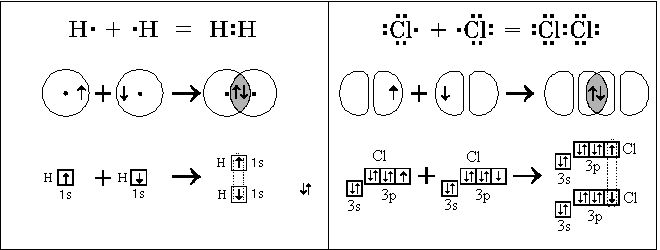
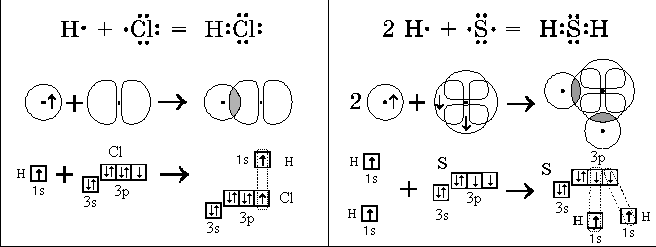
атомам и связывающую их. Так образуется ковалентная
связь.
),
то все они склонны принимать электроны, а
отдавать их не склонны; поэтому отобрать друг у
друга электроны такие атомы не могут. В этом
случае связь между ними возникает за счет
попарного обобществления неспаренных валентных
электронов: один электрон одного атома и один
электрон другого атома с разными спинами
образуют пару электронов, принадлежащую обоим
атомам и связывающую их. Так образуется ковалентная
связь.
Образование ковалентной связи в пространстве
можно представить себе как перекрывание
электронных облаков неспаренных валентных
электронов разных атомов. При этом пара
электронов образует общее электронное облако,
связывающее атомы. Чем больше электронная
плотность в области перекрывания, тем больше
выделяется энергии при образовании такой связи.
Прежде чем рассмотреть простейшие примеры
образования ковалентной связи, договоримся
валентные электроны атома обозначать точками
вокруг символа этого атома, причем парой точек –
неподеленные электронные пары и пары электронов
ковалентной связи, а отдельными точками –
неспаренные электроны. При таком обозначении
валентная электронная конфигурация атома,
например, фтора будет изображаться символом 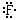 , а атома кислорода –
, а атома кислорода –  . Построенные из таких
символов формулы называются электронными
формулами или формулами Льюиса (американский
химик Гилберт Ньютон Льюис предложил их в 1916
году). По объему передаваемой информации
электронные формулы относятся к группе
структурных формул. Примеры образования атомами
ковалентных связей:
. Построенные из таких
символов формулы называются электронными
формулами или формулами Льюиса (американский
химик Гилберт Ньютон Льюис предложил их в 1916
году). По объему передаваемой информации
электронные формулы относятся к группе
структурных формул. Примеры образования атомами
ковалентных связей:
3. Если связываемые атомы большие (ro >
1А), то все они более или менее склонны отдавать
свои электроны, а склонность принимать чужие
электроны у них незначительна. Поэтому
образовать между собой ионную связь эти большие
атомы тоже не могут. Ковалентная связь между ними
также оказывается невыгодной, так как
электронная плотность в больших по размеру
внешних электронных облаках незначительна. В
этом случае при образовании из таких атомов
химического вещества происходит обобществление
валентных электронов всех связываемых атомов
(валентные электроны становятся общими для всех
атомов), и образуется металлический кристалл (или
жидкость), в котором атомы связаны металлической
связью.
Как определить, связи какого типа образуют
атомы элементов в определенном веществе?
По положению элементов в естественной системе
химических элементов, например:
1. Хлорид цезия CsCl. Атом цезия (IА группа) большой,
легко отдает электрон, а атом хлора (VIIА группа)
маленький и легко его принимает, следовательно,
связь в хлориде цезия ионная.
2. Диоксид углерода CO2. Атомы углерода (IVА
группа) и кислорода (VIА группа) не сильно
отличаются по размерам – оба маленькие. По
склонности принимать электроны они отличаются
незначительно, следовательно связь в молекуле CO2
ковалентная.
3. Азот N2. Простое вещество. Связываемые
атомы одинаковые и при этом маленькие,
следовательно, связь в молекуле азота
ковалентная.
4. Кальций Са. Простое вещество. Связываемые атомы
одинаковые и довольно большие, следовательно
связь в кристалле кальция металлическая.
5. Барий-тетраалюминий BaAl4. Атомы обоих
элементов достаточно велики, особенно атомы
бария, поэтому оба элемента склонны только
отдавать электроны, следовательно, связь в этом
соединении металлическая.
 ИОННАЯ
СВЯЗЬ, КОВАЛЕНТНАЯ СВЯЗЬ, МЕТАЛЛИЧЕСКАЯ СВЯЗЬ,
УСЛОВИЯ ИХ ОБРАЗОВАНИЯ.
ИОННАЯ
СВЯЗЬ, КОВАЛЕНТНАЯ СВЯЗЬ, МЕТАЛЛИЧЕСКАЯ СВЯЗЬ,
УСЛОВИЯ ИХ ОБРАЗОВАНИЯ.
 1.Что является
причиной соединения атомов и образования между
ними химических связей?
1.Что является
причиной соединения атомов и образования между
ними химических связей?
2.Почему благородные газы состоят не из молекул, а
из атомов?
3.Определите тип химической связи в бинарных
соединениях: а) KF, K2S, SF4; б) MgO, Mg2Ba,
OF2; в) Cu2O, CaSe, SeO2. 4.Определите
тип химической связи в простых веществах: а) Na, P,
Fe; б) S8, F2, P4; в) Mg, Pb, Ar.
7.З. Ионы. Ионная связь
В предыдущем параграфе вы познакомились с
ионами, которые образуются, когда отдельные
атомы принимают или отдают электроны. В этом
случае число протонов в атомном ядре перестает
быть равным числу электронов в электронной
оболочке, и химическая частица приобретает
электрический заряд.
Но в состав иона может входить и не одно ядро, как
в молекуле. Такой ион представляет собой единую
систему, состоящую из нескольких атомных ядер и
электронной оболочки. В отличие от молекулы
общее число протонов в ядрах не равно общему
числу электронов в электронной оболочке, отсюда
– электрический заряд иона.
| Ионы – заряженные аналоги атомов и
молекул. |
Какие бывают ионы? То есть, чем они могут
различаться?
По числу атомных ядер ионы делятся на простые (или
одноатомные), то есть содержащие одно ядро
(например: K ,
O2
,
O2 ), и сложные
(или многоатомные), то есть содержащие
несколько ядер (например: CO32
), и сложные
(или многоатомные), то есть содержащие
несколько ядер (например: CO32 , [Fe(H2O)6]3
, [Fe(H2O)6]3 ). Простые ионы
– заряженные аналоги атомов, а сложные –
заряженные аналоги молекул.
). Простые ионы
– заряженные аналоги атомов, а сложные –
заряженные аналоги молекул.
По знаку заряда ионы делятся на катионы и анионы.
Катионы – положительно
заряженные ионы
Анионы – отрицательно заряженные ионы. |
Примеры катионов: K (ион калия), Fe2
(ион калия), Fe2 (ион железа), NH4
(ион железа), NH4 (ион
аммония), [Cu(NH3)4]2
(ион
аммония), [Cu(NH3)4]2 (ион
тетраамминмеди). Примеры анионов: Cl
(ион
тетраамминмеди). Примеры анионов: Cl (хлорид-ион), N3
(хлорид-ион), N3 (нитрид-ион),
PO43
(нитрид-ион),
PO43 (фосфат-ион), [Fe(CN)6]4
(фосфат-ион), [Fe(CN)6]4 (гексацианоферрат-ион).
(гексацианоферрат-ион).
По значению заряда ионы делятся на однозарядные
(K , Cl
, Cl , NH4
, NH4 , NO3
, NO3 и т. п.), двухзарядные
(Са2
и т. п.), двухзарядные
(Са2 ,
O2
,
O2 , SО42
, SО42 и т. д.) трехзарядные
(Аl3
и т. д.) трехзарядные
(Аl3 ,
РО43
,
РО43 и т. п.) и так далее.
и т. п.) и так далее.
Итак, ион РО43 мы назовем трехзарядным
сложным анионом, а ион Са2
мы назовем трехзарядным
сложным анионом, а ион Са2 – двухзарядным
простым катионом.
– двухзарядным
простым катионом.
Кроме этого, ионы различаются еще и своими
размерами. Размер простого иона определяется
радиусом этого иона или ионным радиусом.
Размер сложных ионов охарактеризовать труднее.
Радиус иона, как и радиус атома, непосредственно
измерить невозможно (как вы понимаете, четких
границ у иона нет). Поэтому для характеристики
изолированных ионов используют орбитальные
ионные радиусы (примеры – в таблице 17).
| Орбитальный ионный радиус – радиус
внешнего электронного облака простого иона. |
Таблица 17.Орбитальные радиусы
некоторых простых ионов
Катион |
Заряд, е |
Орбитальный
радиус, А |
Анион |
Заряд, е |
Орбитальный
радиус, А |
Li |
+ 1 |
0,189 |
F |
– 1 |
0,400 |
Na |
+ 1 |
0,278 |
Cl |
– 1 |
0,742 |
K |
+ 1 |
0,592 |
Br |
– 1 |
0,869 |
Rb |
+ 1 |
0,734 |
I |
– 1 |
1,065 |
Cs |
+ 1 |
0,921 |
O2 |
– 2 |
0,46 |
Be2 |
+ 2 |
0,139 |
S2 |
– 2 |
0,83 |
Mg2 |
+ 2 |
0,246 |
Se2 |
– 2 |
0,92 |
Ca2 |
+ 2 |
0,538 |
Te2 |
– 2 |
1,12 |
Sr2 |
+ 2 |
0,683 |
|
|
|
Ba2 |
+ 2 |
0,866 |
|
|
|
Al3 |
+ 3 |
0,221 |
|
|
|
Характеризуя размеры ионов в соединениях,
используют и другие системы ионных радиусов.
В химических реакциях ионы могут образовываться
из нейтральных атомов, из молекул или из других
ионов, например:
Са – 2е– = Са2 ; NО2 + е– = NО2
; NО2 + е– = NО2 ;
;
H2PO4 + H2O = Н3O
+ H2O = Н3O + НРО42
+ НРО42 ; Cu2
; Cu2 + 4Н2O
= [Cu(H2O)4]2
+ 4Н2O
= [Cu(H2O)4]2 .
.
Разноименно заряженные ионы связываются между
собой за счет электростатического притяжения –
образуется ионная связь.
Ионная связь – химическая связь,
образованная электростатическим притяжением
друг к другу разноименно заряженных ионов. |
Так как ионная связь имеет электростатический
характер, то любой простой ион (точечный заряд!)
притягивает противоположно заряженные ионы по
всем направлениям с одинаковой силой. Эта
особенность ионной связи называется ненаправленностью.
Из свойств электрических зарядов следует и
вторая особенность ионной связи – ненасыщаемость.
Смысл ненасыщаемости ионной связи в том, что
каждый ион с одинаковой силой притягивает один,
два, три, четыре и так далее ионов
противоположного знака (если, конечно, они
находятся на одинаковом от него расстоянии).
Число таких ионов зависит только от их размера.
 ПРОСТЫЕ
ИОНЫ, МНОГОАТОМНЫЕ ИОНЫ, КАТИОНЫ,АНИОНЫ,
ОДНОЗАРЯДНВЕ ИОНЫ, ДВУЗАРЯДНЫЕ ИОНЫ,
ТРЕХЗАРЯДНЫЕ ИОНЫ, ОРБИТАЛЬНЫЙ ИОННЫЙ РАДИУС
ПРОСТЫЕ
ИОНЫ, МНОГОАТОМНЫЕ ИОНЫ, КАТИОНЫ,АНИОНЫ,
ОДНОЗАРЯДНВЕ ИОНЫ, ДВУЗАРЯДНЫЕ ИОНЫ,
ТРЕХЗАРЯДНЫЕ ИОНЫ, ОРБИТАЛЬНЫЙ ИОННЫЙ РАДИУС
 1.Охарактеризуйте
следующие ионы по числу атомных ядер, знаку и
значению заряда: Rb
1.Охарактеризуйте
следующие ионы по числу атомных ядер, знаку и
значению заряда: Rb , NO3
, NO3 , Al3
, Al3 , AsO33
, AsO33 , N3
, N3 , SO42
, SO42 , S2
, S2 .
.
2.Определите число протонов и число электронов в
ионе натрия. Составьте его полную и сокращенную
электронную формулу. Проделайте то же для ионов O2 , Ва2
, Ва2 , I
, I , Fe2
, Fe2 и Fe3
и Fe3 .
.
3.Определите число протонов и число электронов в
а) молекуле триоксида серы и сульфит-ионе SO32 , б)
частицах NО, NО
, б)
частицах NО, NО и NО
и NО .
.
4.Используя таблицы орбитальных радиусов,
определите, как изменяется радиус частицы при
образовании а) иона натрия из атома Nа, б)
хлорид-иона из атома С1, в) иона бария из атома Ва,
г) оксид-иона из атома кислорода. Изменение
радиуса выразите в процентах.
5.Почему при образовании катиона калия из атома
калия радиус частицы резко уменьшается, а при
образовании бромидного аниона из атома брома –
практически не изменяется?
6.Вокруг какого из ионов может разместиться
больше одинаковых ионов противоположного знака:
а) Li или Nа
или Nа ;
б) F
;
б) F или Cl
или Cl ?
?