3.6. Сульфирование
Введение в ароматическое соединение группы SO3H называется сульфированием, а образующиеся продукты называются аренсульфокислотами.
![]()
Сульфирование широко используется в промышленном синтезе органических красителей, поверхностно-активных веществ, сульфамидных препаратов и других физиологически активных соединений. В качестве сульфирующего агента чаще всего употребляют 98-100%-ную серную кислоту (моногидрат), 92-94%-ную кислоту (купоросное масло), а также олеум, содержащий от 20-60% серного ангидрида, растворенного в безводной серной кислоте; иногда для сульфирования используют растворы SO3 в SO2 (жидк.) и SO3 в хлористом метилене. Эффективным сульфирующим агентом является хлорсульфоновая кислота (монохлорангидрид серной кислоты), которую получают при взаимодействии серного ангидрида и хлористого водорода. Сульфирование ароматических соединений хлорсульфоновой кислотой представляет собой двухстадийный процесс. На первой стадии образуется сульфокислота.
![]()
Далее она взаимодействует с хлорсульфоновой кислотой с образованием сульфохлорида.
![]()
Для того, чтобы сместить равновесие вправо, необходимо использовать 4-5-кратный избыток ClSO3H. Для сульфирования ароматических соединений, содержащих электронодонорные заместители, а также пятичленных ароматических гетероциклических соединений - фурана, пиррола, тиофена и др., нестабильных в сильнокислой среде, используют комплексы серного ангидрида с пиридином, диоксаном или диметилформамидом.



Важной особенностью реакции сульфирования является ее обратимость. Ароматические сульфокислоты расщепляются перегретым водяным паром в кислой среде при 110-180оС (протодесульфирование представляет собой реакцию электрофильного ароматического ипсо-замещения). На этом свойстве сульфогруппы основано ее использование в качестве защитной группы в синтезе различных полизамещенных бензолов. Например, сульфогруппой можно защитить пара-место бензольного кольца в толуоле, анизоле, анилине и феноле.


3.6.1. Механизм сульфирования
До сих пор нет единого мнения относительно истинной природы электрофильного агента сульфирования. Данные кинетических измерений не дают однозначного ответа на этот вопрос, поскольку в водной и безводной серной кислоте содержится большое число потенциальных электрофильных агентов, относительная концентрация которых зависит от отношения H2O/SO3.
При концентрации серной кислоты ниже 80% устанавливаются главным образом следующие равновесия:
![]() или
или
![]()
При более высокой концентрации серной кислоты в интервале 85-98% состояние серной кислоты в основном описывается уравнениями
![]()
![]()
В 100%-ной серной кислоте и в олеуме помимо H2S2O7 существуют и другие полисерные кислоты - H2S3O10; H2S4O13 и т.д. Все это крайне затрудняет интерпретацию данных по кинетике сульфирования.
В водной серной кислоте при концентрации ниже 80% скорость сульфирования линейно коррелирует с активностью иона H3SO4+ . При концентрации серной кислоты выше 85% наблюдается линейная корреляция с активностью H2S2O7. Эти две частицы, по-видимому, и есть два главных реальных электрофильных агента сульфирования ароматических соединений в водной серной кислоте. Их можно рассматривать как молекулу SO3, координированную соответственно с ионом H3O+ или серной кислотой. При переходе от 85%-ной к 100%-ной серной кислоте концентрация иона H3O+ резко уменьшается, а концентрация H2SO4 увеличивается. В 91%-ной кислоте [H3SO4+ ] = [H2S2O7], но так как H2S2O7 (SO3 . H2SO4) более сильный электрофильный агент, чем H3SO4+ (H3O+ . SO3), он доминирует как электрофил не только в 91%-ной, но даже и в 85%-ной серной кислоте.
Таким образом, механизм сульфирования может быть представлен, по-видимому, следующим образом:

Кинетический изотопный эффект kH/kD
при концентрации серной кислоты ниже 95%
пренебрежимо мал. Но при сульфировании 98-100%-ной H2SO4
или олеумом наблюдается кинетический
изотопный эффект kH/kD в диапазоне
1.15-1.7, т.е. определяющей скорость стадией
становится уже стадия (2). При концентрации серной
кислоты ниже 95% протон от ![]() -комплекса
отщепляется гидросульфат-ионом HSO4- , а при
более высокой концентрации серной кислоты роль
очень слабого основания играет сама H2SO4.
Поэтому скорость стадии (2) резко уменьшается, и
наблюдается кинетический изотопный эффект.
-комплекса
отщепляется гидросульфат-ионом HSO4- , а при
более высокой концентрации серной кислоты роль
очень слабого основания играет сама H2SO4.
Поэтому скорость стадии (2) резко уменьшается, и
наблюдается кинетический изотопный эффект.
В олеуме скорость сульфирования резко возрастает. Электрофильным агентом в этом случае, по-видимому, является не связанный в комплекс SO3. Медленной является стадия (2).
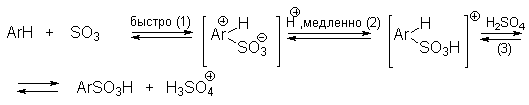
Предположение о наличии нескольких активных частиц сульфирования позволяет объяснить изменение не только скорости, но и ориентации при сульфировании серной или олеумом. Катион H3SO4+ и H2S2O7 должны обладать более высокой селективностью по сравнению с SO3.
При рассмотрении экспериментальных данных по распределению изомерных продуктов сульфирования необходимо иметь в виду, что эта реакция подчиняется не кинетическому, а термодинамическому контролю. Поэтому соотношение орто-, мета- и пара-изомеров при изменении температуры меняется не только потому, что константы скорости сульфирования в орто-, мета- и пара-положения бензольного кольца по-разному меняются с ростом температуры, но и потому, что положение равновесия всех этих процессов также очень сильно зависит от температуры. Так, например, при сульфировании фенола до моносульфокислоты образуется смесь орто- и пара-гидроксибензолсульфокислот. При 20оС образуется приблизительно равное количество орто- и пара-изомеров. Однако при сульфировании фенола при 100оС в реакционной смеси преобладает пара-изомер. При нагревании смеси орто- и пара-изомеров в 80-90%-ной серной кислоте также накапливается пара-изомер. Это объясняется тем, что скорость протодесульфирования орто-изомера больше, чем пара-изомера. орто-Гидроксибензолсульфокислота не только образуется быстрее, но и расщепляется обратно до фенола с большей скоростью; пара-гидроксибензолсульфокислота медленнее образуется, но и медленнее расщепляется. Образование орто-изомера при сульфировании фенола 92-98%-ной серной кислотой при 0оС (условия кинетического контроля сульфирования) указывает на то, что скорость обратной реакции протодесульфирования в этих условиях очень мала. Таким образом пара-изомер при термодинамическом контроле сульфирования фенола становится доминирующим продуктом этой реакции.

Аналогично толуол при сульфировании 100%-ной серной кислотой при 0оС дает 43% орто-, 4% мета- и 53% пара-толуолсульфокислоты, тогда как при 100оС в равновесных условиях наблюдается совершенно иное распределение изомеров: 13% орто-, 8% мета- и 79% пара-толуолсульфокислоты.
Другим классическим примером проявления термодинамического контроля является сульфирование нафталина

В очень мягких условиях образуется только 1-нафталинсульфокис-лота. Этому условию отвечает сульфирование нафталина хлорсульфоновой кислотой или раствором SO3 в дихлорэтане при 0о -(-10оС). Соотношение изомеров при сульфировании 96%-ной серной кислотой зависит от температуры: в более жестких условиях преобладает термодинамически более стабильная 2-нафталинсульфо-кислота.
3.6.2. Сульфирование бензола и его производных
Бензол при действии 92-94%-ной серной кислоты при 40-50оС образует бензолсульфокислоту с выходом 90-96%. Введение одной сульфогруппы уменьшает скорость реакции введения второй сульфогруппы в 104 раз, поэтому мета-бензолсульфо-кислота получается при сульфировании бензола в жестких условиях избытком 20%-ного олеума при 100оС или 60%-ного олеума при 60-80оС. Длительное нагревание мета-бензолсульфокислоты с 90%-ной серной кислотой при 235оС приводит к равновесной смеси, состоящей из 66% мета- и 34% пара-бензолсульфокислоты.

Дальнейшее сульфирование мета-бензолдисульфокислоты до 1,3,5-бензолтрисульфокислоты удается провести только с 60%-ным олеумом при 250оС в присутствии сульфата ртути. Толуол сульфируется в несколько раз быстрее бензола. При этом, как правило, образуется смесь всех трех изомерных толуолсульфокислот.

пара-Толуолсульфокислота плохо растворима в конц.HCl и может быть выделена в чистом виде путем насыщения конц. водного раствора смеси полученных сульфокислот хлористым водородом.
Сульфирование хлорбензола и других галогенбензолов протекает в десять раз медленнее, чем сульфирование бензола, в результате образуется пара-хлорбензолсульфокислота, почти не содержащая орто-изомера.

Нитробензол сульфируется 60%-ным олеумом при 80-100оС исключительно до мета-нитробензолсульфокислоты.

Пара-нитротолуол, как и следовало ожидать, образует при сульфировании 20%-ным олеумом 4-нитро-2-толуолсульфокислоту.

Сульфированием ароматических аминов получают аминосульфокислоты. Аминогруппа является одним из сильнейших электронодонорных ориентантов I-го рода, однако в 90-100%-ной серной кислоте или олеуме она протонируется, причем равновесие практически нацело смещено в сторону протонированной формы. Аммониевая группа NH3+ относится к сильным электроакцепторным заместителям, вызывающим резкое замедление реакции сульфирования и ориентирующим входящий электрофил в мета-положение.

В промышленности метаниловую кислоту получают восстановлением мета-нитробензолсульфокислоты.

Для получения орто- и пара-аминобензолсульфокислот используют обходный метод, который носит название "реакции запекания". Эту реакцию осуществляют при длительном нагревании гидросульфатов ароматических аминов при 100-200оС в сухом виде или в высококипящих органических растворителях, обычно в орто-дихлорбензоле. При температуре около 100оС образуется практически чистый орто-изомер (ортаниловая кислота, продукт кинетического контроля), а при 180-200оС - пара-изомер (сульфаниловая кислота, продукт термодинамического контроля).

Кроме того, имеются данные, что при высоких температурах может протекать конкурентный процесс образования сульфаминовой кислоты, которая затем изомеризуется с переходом сульфогруппы в пара-положение кольца.

3.6.3. Свойства аренсульфокислот
Сульфокислоты, подобно карбоновым кислотам, образуют галогенангидриды, ангидриды, амиды и сложные эфиры. Методы получения этих функциональных производных по существу аналогичны методам, применяемым для получения производных карбоновых кислот. Один из методов получения хлорангидридов сульфокислот (сульфохлоридов) заключается в обработке сухой натриевой соли сульфокислоты тионилхлоридом или пятихлористым фосфором в ДМФА.

В промышленности сульфохлориды получают также прямым сульфированием аренов 4-5 эквивалентами хлорсульфоновой кислоты. Амиды и сложные эфиры сульфокислот легко получаются из сульфохлоридов с помощью стандартных методов.

Производные амида сульфаниловой кислоты (сульфамидные препараты; лекарственные вещества антимикробного действия) получают по следующей схеме:

Алкилтозилаты ROTs, алкилтрифлаты CF3SO3R (ROTf) и другие алкилсульфонаты нашли широкое применение в качестве алкилирующих агентов в реакциях бимолекулярного и мономолекулярного нуклеофильного замещения.

![]()
Алкилтозилаты восстанавливаются до углеводородов с помощью литийалюминийгидрида

Сульфогруппа может быть замещена на нитрогруппу или галоген. Эти электрофильные реакции ипсо-замещения широко используются в органическом синтезе, например, при получении пикриновой кислоты или 2,4,6-трибромфенола


Важное значение в органическом синтезе имеют также реакции нуклеофильного замещения сульфогруппы. Сплавлением щелочных солей сульфокислот с твердыми щелочами и цианидами натрия и калия получают, соответственно, фенолы и нитрилы ароматических килот (арилцианиды).



