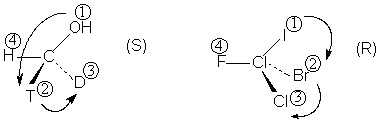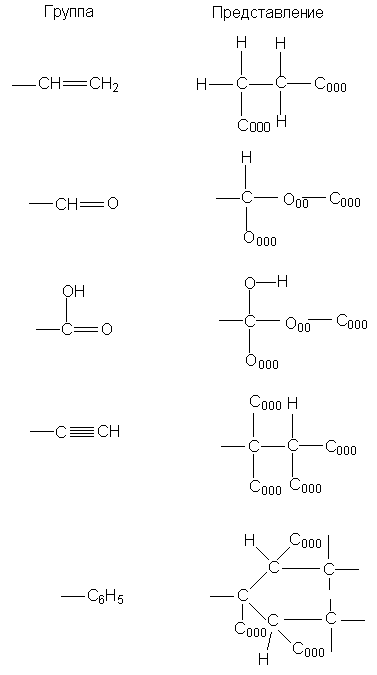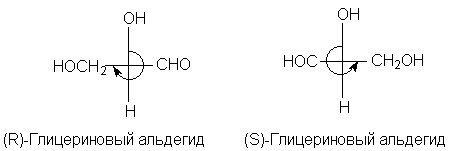|
Бутин К.П. Теоретическая стереохимия/ Органическая химия
8.3.3. Система Кана-Ингольда-Прелога
Система Фишера в свое время позволила создать
логичную и непротиворечивую стереохимическую
систематику большого числа природных
соединений, ведущих свое происхождение от
аминокислот и сахаров. Относительная
конфигурация энантиомеров в этой системе
определялась путем химической корреляции, т.е.
путем перехода от данной молекулы к D- или
L-глицериновому альдегиду через
последовательность химических реакций, не
затрагивающих асимметрический атом углерода
(подробнее см.раздел 8.5). Вместе с тем, если
молекула, конфигурацию которой требовалось
установить, по своей структуре очень сильно
отличалась от глицеринового альдегида,
скоррелировать ее конфигурацию с конфигурацией
глицеринового альдегида химическим путем было
бы очень обременительно. Кроме того, отнесение
конфигурации к D - или L - ряду не всегда было
однозначно. Например, D-глицериновый альдегид, в
принципе, можно превратить в глицериновую
кислоту, затем действием диазометана - в
метиловый эфир, и далее селективным окислением
первичной спиртовой функции и этерификацией
диазоэтаном в метиловоэтиловый эфир
гидроксималоновой кислоты (XXV). Все эти реакции не
затрагивают хиральный центр и поэтому можно
сказать, что диэфир XXV относится к D - ряду.
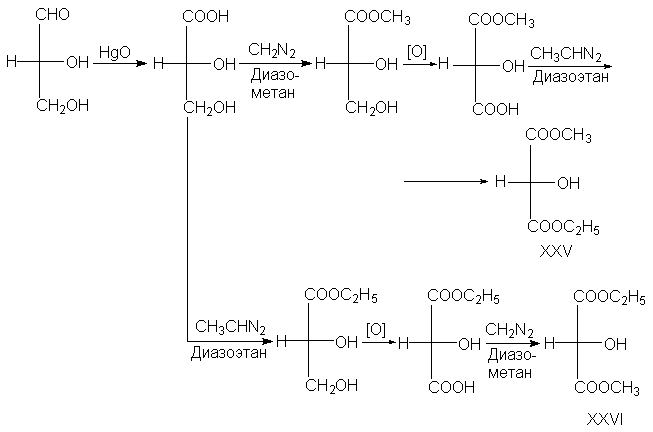
Если же первую этерификацию проводить
диазоэтаном, а вторую диазометаном, то получится
диэфир XXVI, который по той же причине также
следует отнести к D-ряду. На самом же деле
соединения XXV и XXVI представляют собой
энантиомеры; т.е. одни относятся к D- а другие к L-
ряду. Таким образом, отнесение зависит от того,
какую из сложноэфирных групп, CO2Et или CO2Me,
признать "главной".
Указанные ограничения фишеровской системы, а
также тот факт, что в 1951 г. появился
рентгеноструктурный метод определения
истинного расположения групп вокруг хирального
центра, привели к соэданию в 1966 году новой, более
строгой и непротиворечивой системы описания
стереоизомеров, известной под названием
R,S-номенклатуры Кана-Ингольда-Прелога (КИП) или
правил последовательного старшинства. Эта
система в настоящее время практически вытеснила
D,L- систему Фишера (последняя, однако, все еще
употребляется для углеводов и аминокислот). В
системе КИП к обычному химическому названию
прибавляются специальные дескрипторы R- или S-,
строго и однозначно определяющие абсолютную
конфигурацию.
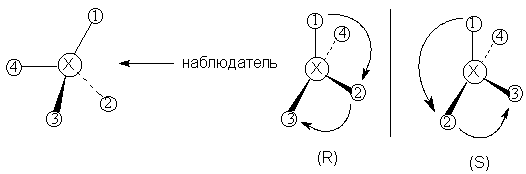
Возьмем соединение типа Xabcd, содержащее один
асимметрический центр Х. Чтобы установить его
конфигурацию, четыре заместителя у атома Х
следует пронумеровать и расположить в ряд в
порядке уменьшения старшинства (см. ниже), т.е.
1>2>3>4. Заместители рассматриваются
наблюдателем со стороны наиболее удаленной от
самого младшего заместителя (обозначенного
номером 4). Если при этом направление убывания
старшинства 1  2 2  3 совпадает с движением по
часовой стрелке, то конфигурацию данного
асимметрического центра обозначают символом R
(от латинского rectus - правый) а если против часовой
стрелки - символом S (sinister - левый). 3 совпадает с движением по
часовой стрелке, то конфигурацию данного
асимметрического центра обозначают символом R
(от латинского rectus - правый) а если против часовой
стрелки - символом S (sinister - левый).
Приведем несколько правил последовательного
старшинства, достаточных для рассмотрения
подавляющего большинства хиральных соединений.
1) Предпочтение по старшинству отдается атомам
с более высокими атомными номерами. Если номера
одинаковы (в случае изотопов), то более старшим
считается атом с наибольшей атомной массой.
Самый младший "заместитель" - неподеленная
электронная пара. Таким образом, старшинство
возрастает в ряду: неподеленная пара < H < D < T
< Li < B < C < N < O < F < Si < P <S < Cl <Br < I.
Например:
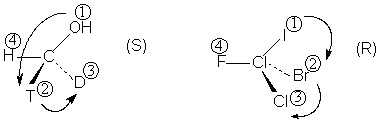
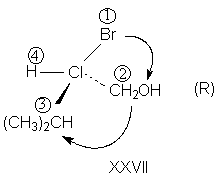
2) Если с асимметрическим атомом
непосредственно связано два, три или все четыре
одинаковых атома, порядок устанавливается по
атомам второго пояса, которые связаны уже не с
хиральным центром, а с теми атомами, которые
имели одинаковое старшинство. Например, в
молекуле XXVII по первому атому групп СН2ОН и
(СН3)2СН установить старшинство не
удается, однако предпочтение отдается СН2ОН,
так как атомный номер кислорода больше, чем
углерода. Группа СН2ОН старше, несмотря на
то, что в ней с атомом углерода связан лишь один
атом кислорода, а в группе СН(СН3)2 -
два атома углерода. Если и вторые атомы в группе
одинаковы, порядок определяется по атомам
третьего пояса и т.д.
Если и такая процедура не привела к построению
однозначной иерархии, ее продолжают на все более
возрастающих расстояниях от центрального атома,
пока, наконец, не встретится различия и все
четыре заместителя все-таки получат свое
старшинство. При этом любое предпочтение,
приобретаемое тем или иным заместителем на одной
из стадий согласования старшинства считается
окончательным и на последующих стадиях
переоценке не подлежит. Если в молекуле
встречаются точки разветвления, процедуру
установления старшинства следует продолжать
вдоль молекулярной цепи наибольшего
старшинства. При установлении старшинства того
или иного центрального атома решающее значение
имеет число связанных с ним других атомов
высшего старшинства. Например, CCl3 > CHCl2
> CH2Cl.
3) Формально принимается, что валентность всех
атомов, кроме водорода, равна 4. Если истинная
валентность атома меньше (например, у кислорода,
азота, серы), то считается, что у этого атома
имеется 4-n (где n - настоящая валентность) так
называемых фантом-заместителей, которым
приписывается нулевой порядковый номер и
отводится последнее место в перечне
заместителей. В соответствии с этим группы с
двойными и тройными связями представляются так,
как если бы они были расщеплены на две или три
простые связи. Например, при представлении
двойной связи С=С каждый атом рассматривается
как связанный с двумя атомами углерода, причем
считается, что второй из этих атомов углерода
имеет три фантом-заместителя. В качестве примера
рассмотрим представления групп -СН=СН2,
-СНО, -СООН, -С СН и -С6Н5. Эти
представления выглядят следующим образом. СН и -С6Н5. Эти
представления выглядят следующим образом.
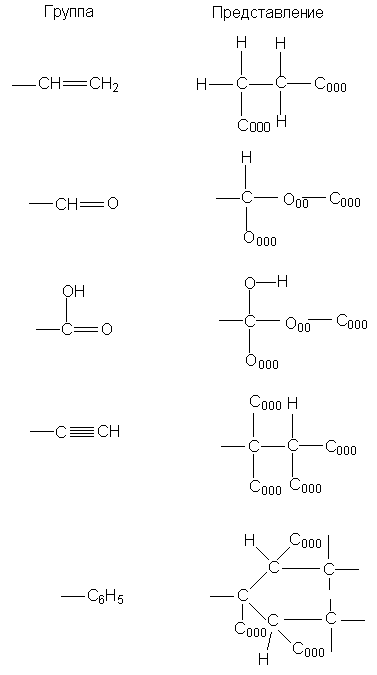
Первые атомы во всех этих группах связаны
соответственно с (Н,С,С), (Н,О,О), (О,О,О), (С,С,С) и
(С,С,С). Этой информации достаточно, чтобы группу
СООН поставить на первом месте (самая старшая),
группу СНО на втором, а группу -СН=СН2 - на
последнем (пятом) месте, поскольку наличие хотя
бы одного атома кислорода предподчтительнее
наличия даже трех атомов углерода. Чтобы сделать
вывод об относительном старшинстве групп С СН и -С6Н5 нужно пойти
дальше по цепи. Группа С6Н5 имеет два
атома углерода типа (С,С,С), связанные с (С,С,Н), а
третий атом относится к типу (О,О,О). Группа С СН и -С6Н5 нужно пойти
дальше по цепи. Группа С6Н5 имеет два
атома углерода типа (С,С,С), связанные с (С,С,Н), а
третий атом относится к типу (О,О,О). Группа С СН имеет только одну группировку
(С,С,Н), но две группировки (О,О,О). Следовательно, С6Н5
старше, чем С СН имеет только одну группировку
(С,С,Н), но две группировки (О,О,О). Следовательно, С6Н5
старше, чем С СН, т.е. по порядку
старшинства пять указанных групп займут ряд:
СООН> СНО> С6Н5> С СН, т.е. по порядку
старшинства пять указанных групп займут ряд:
СООН> СНО> С6Н5> С СН> СН=СН2.
СН> СН=СН2.
Старшинство наиболее часто встречающихся
заместителей можно определить по табл. 8-2, в
которой условный номер означает большее
старшинство.
Таблица 8.2.
Старшинство некоторых групп по
Кану-Ингольду-Прелогу
Группа |
Условный номер |
Группа |
Условный номер |
| Аллил, - СНСН=СН2 |
10 |
Меркапто, - SH |
69 |
| Амино, - NH2 |
43 |
Метил, -CH3 |
2 |
| Аммонио, - NH3+ |
44 |
Метиламино, - NHCH3 |
45 |
| Ацетил, - COCH3 |
36 |
Метилсульфинил,
- SOCH3 |
71 |
| Ацетиламино, - NHCOCH3 |
48 |
Метилсульфинилокси,
- OSOCH3 |
66 |
| Ацетокси, - OCOCH3 |
64 |
Метилсульфонил,
- SO2CH3 |
72 |
| Бензил, - CH2C6H5 |
13 |
Метилсульфонилокси,
- OSO2CH3 |
67 |
| Бензилокси, - OCH2C6H5 |
60 |
Метилтио, - SCH3 |
70 |
| Бензоил, - COC6H5 |
37 |
Метокси, - OCH3 |
58 |
| Бензоиламино, - NHCOC6H5 |
49 |
Метилкарбонил,
- COOCH3 |
30 |
| Бензоилокси, - OCOC6H5 |
65 |
Неопентил,
- CH2C(CH3)3 |
11 |
| Бензоилоксикарбонил-амино, - NHCOOCH2C6H5 |
50 |
Нитро, - NO2 |
56 |
| Бром, - Br |
75 |
Нитрозо, - NO |
55 |
| втор-Бутил, -CH(CH3)CH3CH3 |
16 |
м-нитрофенил, 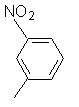 |
27 |
| н-Бутил, - CH2CH2CH2CH3 |
5 |
о-нитрофенил, 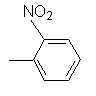 |
33 |
| трет-Бутил, - C(CH3)3 |
19 |
п-нитрофенил, 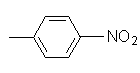 |
24 |
трет-Бутоксикарбонил,
- COOC(CH3)3 |
42 |
Пентил, - C5H11 |
6 |
| Винил, - CH2 = CH2 |
15 |
Пропенил,
- CH=CHCH3 |
18 |
| Водород, - H |
1 |
Пропил, - CH2CH2CH3 |
4 |
| н-Гексил, - C6H13 |
7 |
Пропинил, - C CCH3 CCH3 |
29 |
| Гидрокси, - OH |
57 |
Пропаргил,
- CH2C CH CH |
12 |
| Гликозилокси |
62 |
Сульфо, - SO3H |
73 |
| Диметиламино, - N(CH3)2 |
51 |
м-Толил, 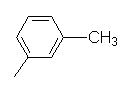 |
25 |
2,4-Динитрофенил, 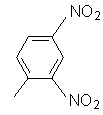 |
34 |
о-Толил, 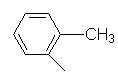 |
30 |
3,5-Динитрофенил, 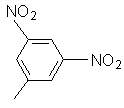 |
28 |
п-Толил, 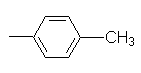 |
23 |
| Диэтиламино, - N(C2H5)2 |
52 |
Триметиламмонио, 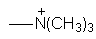 |
53 |
| Изобутил, - CH2CH(CH3)2 |
9 |
Тритил, - C(C6H5)3 |
32 |
Изопентил,
- CH2CH2CH(CH3)2 |
8 |
Фенил, - C6H5 |
22 |
Изопропенил,
- CH(CH3)=CH2 |
20 |
Фенилазо, - N=NCC6H5 |
54 |
| Изопропил, - CH(CH3)2 |
14 |
Фениламино, - NHC6H5 |
47 |
| Иод, - I |
76 |
Фенокси, - OC6H5 |
61 |
| Карбоксил, - COOH |
38 |
Формил, - CHO |
35 |
2,6-Ксилил, 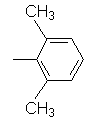 |
31 |
Формилокси, - OCHO |
63 |
3,5-Ксилил, 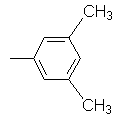 |
26 |
Фтор, - F |
68 |
| |
|
Хлор, - Cl |
74 |
| |
|
Циклогексил,- C6H11 |
17 |
| |
|
Этил, - CH2CH3 |
3 |
| |
|
Этиламино, - NHC2H5 |
46 |
| |
|
Этинил, - C CH CH |
21 |
| |
|
Этокси, - OC2H5 |
59 |
| |
|
Этоксикарбонил,
- COOC2H5 |
40 |
Правила последовательного старшинства были
специально задуманы так, чтобы оказаться в
максимально близком соответствии с ранней
систематикой Фишера, так как по счастливой
случайности оказалось, что D-глицериновый
альдегид имеет действительно такую
конфигурацию, которая ему произвольно была
приписана вначале. В результате большинство
D-центров и, что очень важно, сам глицериновый
альдегид, имеют (R)-конфигурацию, а L-стереоизомеры
обычно принадлежат к (S)-ряду.
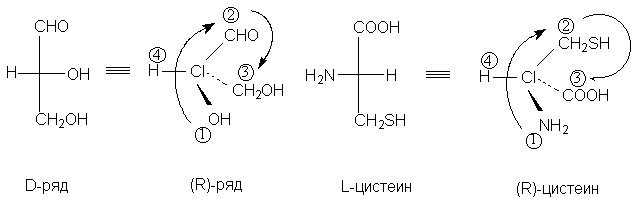
Одним из исключений является L-цистеин, который
принадлежит к (R)-ряду, так сера по правилам
старшинства предпочтительнее кислорода. В
ситеме КИП генетическое родство между
молекулами во внимание не принимается. Эта
система может применяться только к соединениям с
известной абсолютной конфигурацией. Если
конфигурация неизвестна, то соединение
приходится обязательно характеризовать знаком
его вращения.
Правила последовательного старшинства
применимы также и к описанию геометрических
изомеров непредельных соединений. Заместители у
каждого конца кратной связи при установлении
старшинства должны рассматриваться отдельно.
Если заместители, имеющие более высокое
старшинство, расположены с одной и той же стороны
двойной связи, соединению присваивают префикс Z -
(от немецкого zusammen - вместе), а если по разные
стороны, то префикс Е (entgegen - напротив). (Z, Е) -
Номенклатура алкенов рассмтривалась в гл.5. Ниже
приведены примеры отнесения структур с
использованием (Z, Е) - обозначений.
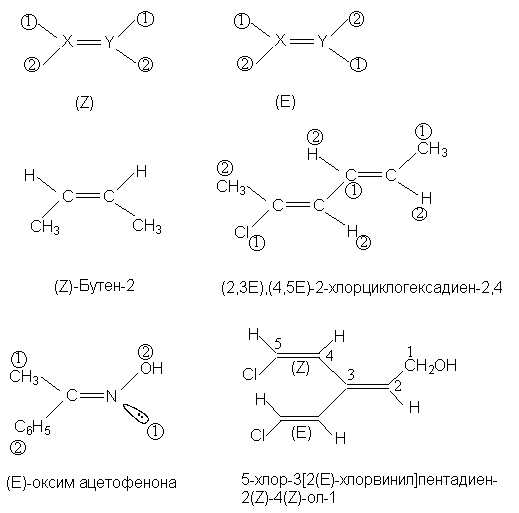
Последний пример показывает, что
преимущественное право включения в главную цепь
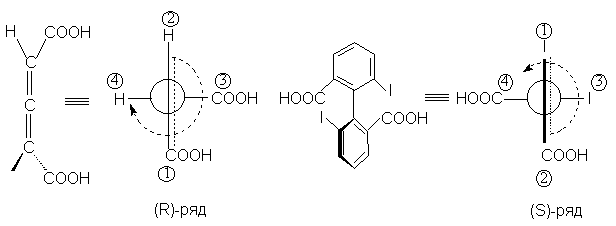
имеет звено с Z - конфигурацией. (R,S) - Обозначения
могут быть применены и для соединений с
аксиальной хиральностью. Для отнесения
конфигурации изображают проекцию Ньюмена на
плоскость, перпендикулярную хиральной оси, и
далее применяют дополнительное правило,
согласно которому заместители на конце оси,
ближайшей к наблюдателю, рассматриваются как
имеющие более высокое старшинство, чем
заместители на дальнем конце оси. Тогда
конфигурацию молекулы определяют направлением
обхода заместителей по или против часовой
стрелки в обычном порядке убывания старшинства
от первого ко второму и затем третьему лиганду.
Ниже это проиллюстрировано для 1,3 -
аллендикарбоновой и 2,2 -
иодиддифенил-6,6-дикарбоновой кислот.
Правило последовательного старшинства
разработаны также для планарно и спирально
хиральных молекул.
При изображении соединений с помощью
фишеровских проекций можно легко определить
конфигурацию без построения пространственных
моделей. Формулу надо записать так, чтобы младший
заместитель находился внизу; если при этом
остальные заместители в порядке уменьшения
старшинства располагаются по часовой стрелке,
соединение относят к (R) - ряду, а если против
часовой - то к (S) -ряду, например:
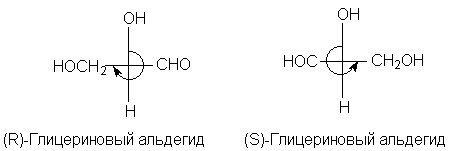
Если младшая группа не находится внизу, то
следует поменять ее местами с нижней группой, но
следует помнить, что при этом происходит
обращение конфигурации.
|