|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
12. Гальванический элемент
Для гальванического элемента принята
следующая форма записи (на примере элемента
Даниэля):
Zn | ZnSO4 || CuSO4 | Cu,
где вертикальная линия | обозначает границу
раздела фаз, а двойная вертикальная линия || -
солевой мостик. Электрод, на котором происходит
окисление, называется анодом; электрод, на
котором происходит восстановление, называется катодом.
Гальванический элемент принято записывать так,
чтобы анод находился слева.
Электродные полуреакции принято записывать
как реакции восстановления (таблица 12.1), поэтому
общая реакция в гальваническом элементе
записывается как разность между реакциями на
правом и левом электродах:
Правый электрод: Cu2+ + 2e = Cu
Левый электрод: Zn2+ + 2e = Zn
Общая реакция: Cu2+ + Zn = Cu + Zn2+
Потенциал E электрода рассчитывается по формуле
Нернста:
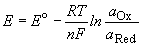 , ,
где aOx и aRed - активности
окисленной и восстановленной форм вещества,
участвующего в полуреакции; Eo - стандартный
потенциал электрода (при aOx = aRed
=1); n - число электронов, участвующих в
полуреакции; R - газовая постоянная; T -
абсолютная температура; F - постоянная
Фарадея. При 25o C

Стандартные электродные потенциалы электродов
измеряются относительно стандартного
водородного электрода, потенциал которого
принят равным нулю. Значения некоторых
стандартных электродных потенциалов приведены в
таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна
разности потенциалов правого и левого
электродов:
E = EП - EЛ.
Если ЭДС элемента положительна, то реакция (так,
как она записана в элементе) протекает
самопроизвольно. Если ЭДС отрицательна, то
самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных
потенциалов:
 . .
Для элемента Даниэля стандартная ЭДС равна
Eo = Eo (Cu2+/Cu) - Eo (Zn2+/Zn)
= +0.337 - (-0.763) = +1.100 В.
ЭДС элемента связана с  G протекающей в элементе реакции: G протекающей в элементе реакции:
 G = - nFE. G = - nFE.
Зная стандартную ЭДС, можно рассчитать
константу равновесия протекающей в элементе
реакции:
 . .
Константа равновесия реакции, протекающей в
элементе Даниэля, равна
 = 1.54. 1037. = 1.54. 1037.
Зная температурный коэффициент ЭДС  , можно найти другие
термодинамические функции: , можно найти другие
термодинамические функции:
 S = S = 
 H = H =  G + T G + T S = - nFE + S = - nFE +  . .
Таблица 12.1. Стандартные электродные потенциалы
при 25o С.
(Более полные данные можно найти в
базе по
окислительно-восстановительныи потенциалам
Электрод |
Электродная
реакция |
Eo , В |
| Li+/Li |
Li+ + e = Li |
-3.045 |
| K+/K |
K+ + e = K |
-2.925 |
| Ba2+/Ba |
Ba2+ + 2e = Ba |
-2.906 |
| Ca2+/Ca |
Ca2+ + 2e = Ca |
-2.866 |
| Na+/Na |
Na+ + e = Na |
-2.714 |
| La3+/La |
La3+ + 3e = La |
-2.522 |
| Mg2+/Mg |
Mg2+ + 2e = Mg |
-2.363 |
| Be2+/Be |
Be2+ + 2e = Be |
-1.847 |
| A13+/A1 |
Al3+ + 3e = Al |
-1.662 |
| Ti2+/Ti |
Ti2+ + 2e = Ti |
-1.628 |
| Zr4+/Zr |
Zr4+ + 4e = Zr |
-1.529 |
| V2+/V |
V2+ + 2e = V |
-1.186 |
| Mn2+/Mn |
Mn2+ + 2e = Mn |
-1.180 |
| WO42-/W |
WO42- + 4H2O + 6e = W + 8OH- |
-1.05 |
| Se2-/Se |
Se + 2e = Se2- |
-0.77 |
| Zn2+/Zn |
Zn2+ + 2e = Zn |
-0.763 |
| Cr3+/Cr |
Cr3+ + 3e = Cr |
-0.744 |
| Ga3+/Ga |
Ga3+ + 3e = Ga |
-0.529 |
| S2-/S |
S + 2e = S2- |
-0.51 |
| Fe2+/Fe |
Fe2+ + 2e = Fe |
-0.440 |
| Cr3+,Cr2+/Pt |
Cr3+ + e = Cr2+ |
-0.408 |
| Cd2+/Cd |
Cd2+ + 2e = Cd |
-0.403 |
| Ti3+, Ti2+/Pt |
Ti3+ + e = Ti2+ |
-0.369 |
| Tl+/Tl |
Tl+ + e = Tl |
-0.3363 |
| Co2+/Co |
Co2+ + 2e = Co |
-0.277 |
| Ni2+/Ni |
Ni2+ + 2e = Ni |
-0.250 |
| Mo3+/Mo |
Mo3+ + 3e = Mo |
-0.20 |
| Sn2+/Sn |
Sn2+ + 2e = Sn |
-0.136 |
| Pb2+/Pb |
Pb2+ + 2e = Pb |
-0.126 |
| Ti4+, Ti3+/Pt |
Ti4+ +e = Ti3+ |
-0.04 |
| D+/D2, Pt |
D+ + e = 1/2 D2 |
-0.0034 |
| H+/H2, Pt |
H+ + e = 1/2 H2 |
0.000 |
| Ge2+/Ge |
Ge2+ + 2e = Ge |
+0.01 |
| Br-/AgBr/Ag |
AgBr + e = Ag + Br- |
+0.0732 |
| Sn4+, Sn2+/Pt |
Sn4+ + 2e = Sn2+ |
+0.15 |
| Cu2+, Cu+/Pt |
Cu2+ + e = Cu+ |
+0.153 |
| Cu2+/Cu |
Cu2+ + 2e = Cu |
+0.337 |
| Fe(CN)64-, Fe(CN)63-/Pt |
Fe(CN)63- + e = Fe(CN)64- |
+0.36 |
| OH-/O2, Pt |
l/2 O2 + H2O + 2e
= 2OH- |
+0.401 |
| Cu+/Cu |
Cu+ + e = Cu |
+0.521 |
| J-/J2, Pt |
J2 + 2e = 2J- |
+0.5355 |
| Te4+/Te |
Te4+ + 4e = Te |
+0.56 |
| MnO4-, MnO42-/Pt |
MnO4- + e = MnO42- |
+0.564 |
| Rh2+/Rh |
Rh2+/Rh |
+0.60 |
| Fe3+, Fe2+/Pt |
Fe3+ + e = Fe2+ |
+0.771 |
| Hg22+/Hg |
Hg22+ + 2e = 2Hg |
+0.788 |
| Ag+/Ag |
Ag+ + e = Ag |
+0.7991 |
| Hg2+/Hg |
Hg2+ + 2e = Hg |
+0.854 |
| Hg2+, Hg+/Pt |
Hg2+ + e = Hg+ |
+0.91 |
| Pd2+/Pd |
Pd2+ + 2e = Pd |
+0.987 |
| Br-/Br2, Pt |
Br2 + 2e = 2Br- |
+1.0652 |
| Pt2+/Pt |
Pt2+ + 2e = Pt |
+1.2 |
| Mn2+, H+/MnO2, Pt |
MnO2 + 4H+ + 2e = Mn2+ + 2H2O |
+1.23 |
| Cr3+, Cr2O72-, H+/Pt |
Cr2O72- + 14H+ +
6e = 2Cr3+ + 7H2O |
+1.33 |
| Tl3+, Tl+/Pt |
Tl3+ + 2e = Tl+ |
+1.25 |
| Cl-/Cl2, Pt |
Cl2 + 2e = 2Cl- |
+1.3595 |
| Pb2+, H+/PbO2, Pt |
PbO2 + 4H+ + 2e = Pb2+ + 2H2O |
+1.455 |
| Au3+/Au |
Au3+ + 3e = Au |
+1.498 |
| MnO4-, H+/MnO2,
Pt |
MnO4- + 4H+ + 3e = MnO2
+ 2H2O |
+1.695 |
| Ce4+, Ce3+/Pt |
Ce4+ + e = Ce3+ |
+1.61 |
| SO42-,H+/PbSO4,
PbO2, Pb |
PbO2 + SO42- + 4H+
+ 2e =
PbSO4 + 2H2O |
+1.682 |
| Au+/Au |
Au+ + e = Au |
+1.691 |
| H-/H2, Pt |
H2 + 2e = 2H- |
+2.2 |
| F-/F2, Pt |
F2 + 2e = 2F- |
+2.87 |
ПРИМЕРЫ
Пример 12-1. Рассчитать стандартный
электродный потенциал пары Cu2+/Cu+ по
данным таблицы 11.1 для пар Cu2+/Cu и Cu+/Cu.
Решение.
Cu2+ + 2e = Cu  Go
= -nFEo = -2(96485 Кл. моль-1)(+0.337
В) = -65031 Дж. моль-1. Go
= -nFEo = -2(96485 Кл. моль-1)(+0.337
В) = -65031 Дж. моль-1.
Cu+ + e = Cu  Go
= -nFEo = -(96485 Кл. моль-1)(+0.521 В)
= -50269 Дж. моль-1. Go
= -nFEo = -(96485 Кл. моль-1)(+0.521 В)
= -50269 Дж. моль-1.
Вычитая, получаем:
Cu2+ + e = Cu+  Go
= -nFEo = -3(96485 Кл. моль-1)Eo
= -14762 Дж. моль-1, Go
= -nFEo = -3(96485 Кл. моль-1)Eo
= -14762 Дж. моль-1,
откуда Eo = +0.153 В.
Пример 12-2. Составить схему гальванического
элемента, в котором протекает реакция
Ag+ + Br- = AgBr.
Рассчитать стандартную ЭДС элемента при 25o
C,  Go и
константу равновесия реакции и растворимость AgBr
в воде. Go и
константу равновесия реакции и растворимость AgBr
в воде.
Решение.
Ag | AgBr| Br- || Ag+ | Ag
Правый электрод: Ag+ + e = Ag Eo = 0.7792 В
Левый электрод: AgBr + e = Ag + Br- Eo =
0.0732 В
Общая реакция: Ag+ + Br- = AgBr Eo =
0.7260 В
 Go = -nFEo
= -(96485 Кл.моль-1)(0.7260 В) = -70.05 кДж.
моль-1 Go = -nFEo
= -(96485 Кл.моль-1)(0.7260 В) = -70.05 кДж.
моль-1
 = 1.872. 1012 = 1.872. 1012
1/K= a(Ag+). a(Br-) = m(Ag+).
m(Br-). (  )2 = m2 ( )2 = m2 (  )2 )2
Отсюда, полагая   = 1, получаем m = 7.31. 10-7
моль. кг-1 = 1, получаем m = 7.31. 10-7
моль. кг-1
Пример 12-3.  H
реакции Pb + Hg2Cl2 = PbCl2 + 2Hg,
протекающей в гальваническом элементе, равно -94.2
кДж. моль-1 при 298.2 K. ЭДС этого
элемента возрастает на 1.45. 10-4 В
при повышении температуры на 1К. Рассчитать ЭДС
элемента и H
реакции Pb + Hg2Cl2 = PbCl2 + 2Hg,
протекающей в гальваническом элементе, равно -94.2
кДж. моль-1 при 298.2 K. ЭДС этого
элемента возрастает на 1.45. 10-4 В
при повышении температуры на 1К. Рассчитать ЭДС
элемента и  S при 298.2
K. S при 298.2
K.
Решение.
 = 2. 96485.
1.45. 10-4 = 28.0 (Дж. моль-1.
K-1). = 2. 96485.
1.45. 10-4 = 28.0 (Дж. моль-1.
K-1).
 G = G =  H - T H - T S
= -nFE, откуда S
= -nFE, откуда
 = =  = 0.531 (В). = 0.531 (В).
Ответ.  S = 28. Дж.
моль-1 K-1; E = 0.531 В. S = 28. Дж.
моль-1 K-1; E = 0.531 В.
ЗАДАЧИ
12-1. Рассчитать стандартный
электродный потенциал пары Fe3+/Fe по данным
таблицы 12.1 для пар Fe2+/Fe и Fe3+/Fe2+. (ответ)
12-2. Рассчитать произведение
растворимости и растворимость AgCl в воде при 25o
C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение
растворимости и растворимость Hg2Cl2 в
воде при 25o C по данным о стандартных
электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия
реакции диспропорционирования 2Cu+  Cu2+ + Cu при 25o C. (ответ) Cu2+ + Cu при 25o C. (ответ)
12-5. Рассчитать константу равновесия
реакции ZnSO4 + Cd = CdSO4 + Zn при 25o C по
данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо
протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg,
равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать  G, G,  H и H и  S реакции.
(ответ) S реакции.
(ответ)
12-7. Вычислить тепловой эффект реакции
Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в
гальваническом элементе при 273 К, если ЭДС
элемента E= 1.015 В и температурный коэффициент
ЭДС = - 4.02. 10-4 В. K-1. (ответ)
12-8. В гальваническом элементе при
температуре 298 К обратимо протекает реакция Cd +
2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии
реакции, если стандартная ЭДС элемента Eo
= 0.6753 В, а стандартные энтальпии образования CdCl2
и AgCl равны -389.7 и -126.9 кДж. моль-1
соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag
при 25o C равна 0.322 В. Чему равен pH раствора HCl.
(ответ)
12-10. Растворимость Cu3(PO4)2
в воде при 25o C равна 1.6. 10-8
моль. кг-1. Рассчитать ЭДС
элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2
(насыщ. р-р) | Cu при 25o C. (ответ)
12-11. Три гальванических элемента имеют
стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25o
C. Рассчитать константы равновесия реакций,
протекающих в этих элементах, если количество
электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в
широком интервале температур описывается
уравнением: Eo (В) = 0.07131 - 4.99. 10-4(T
- 298) - 3.45. 10-6(T - 298)2.
Рассчитать  Go , Go ,
 Ho и Ho и  So реакции,
протекающей в элементе, при 25o C. (ответ) So реакции,
протекающей в элементе, при 25o C. (ответ)
12-13. Для измерения pH раствора можно
применять хингидронный электрод. (Хингидрон, Q.
QH2, представляет собой комплекс хинона, Q = C6H4O2,
и гидрохинона, QH2 = C6H4O2H2).
Электродная полуреакция записывается как Q + 2H+
+ 2e  QH2, стандартный
потенциал Eo = +0.6994 В. Если элемент Hg | Hg2Cl2
| HCl | Q. QH2 | Pt имеет ЭДС +0.190 В, каков pH
раствора HCl. (ответ) QH2, стандартный
потенциал Eo = +0.6994 В. Если элемент Hg | Hg2Cl2
| HCl | Q. QH2 | Pt имеет ЭДС +0.190 В, каков pH
раствора HCl. (ответ)
12-14. В гальваническом элементе
обратимо протекает реакция CuSO4 + Zn = ZnSO4
+ Cu. Рассчитать  H и H и  S реакции, если ЭДС
элемента равна 1.960 В при 273 К и 1.961 В при 276 К. (ответ) S реакции, если ЭДС
элемента равна 1.960 В при 273 К и 1.961 В при 276 К. (ответ)
12-15. В элементе Вестона протекает
реакция Cd + Hg2SO4 = Cd2+ + 2Hg.
Рассчитать ЭДС этого элемента при 303 K, если  H и H и  S протекающей в нем реакции равны
соответственно -198.8 кДж. моль-1 и -7.8
Дж. моль-1 K-1. (ответ) S протекающей в нем реакции равны
соответственно -198.8 кДж. моль-1 и -7.8
Дж. моль-1 K-1. (ответ)
12-16.  H
реакции Pb + 2AgCl = PbCl2 + 2Ag, протекающей в
гальваническом элементе, равно -105.1 кДж.
моль-1. ЭДС этого элемента равна 0.4901 В при
298.2 K. Рассчитать ЭДС элемента при 293.2 K. (ответ) H
реакции Pb + 2AgCl = PbCl2 + 2Ag, протекающей в
гальваническом элементе, равно -105.1 кДж.
моль-1. ЭДС этого элемента равна 0.4901 В при
298.2 K. Рассчитать ЭДС элемента при 293.2 K. (ответ)
|

 .
. = 1.54. 1037.
= 1.54. 1037. = 1.872. 1012
= 1.872. 1012