|
Учебные материалы по физической химии
Задачи по физической химии.Часть 2.Химическая кинетика. Электрохимия
Биологический факультет
Задачи письменных экзаменов
(Досрочный экзамен по физической химии (4-й семестр)
1. Скорость автокаталитической реакции A 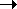 P описывается кинетическим
уравнением v = k. [A]. [P]. Решите это
кинетическое уравнение (т.е., найдите зависимость
степени превращения от времени). Начальные
концентрации: [A]0 = a, [P]0 = p. P описывается кинетическим
уравнением v = k. [A]. [P]. Решите это
кинетическое уравнение (т.е., найдите зависимость
степени превращения от времени). Начальные
концентрации: [A]0 = a, [P]0 = p.
2. Термическое дегидрирование этана протекает
по следующему механизму:
C2H6 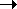 2CH3. 2CH3.
CH3. + C2H6 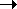 CH4 + C2H5. CH4 + C2H5.
C2H5. 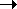 C2H4
+ H. C2H4
+ H.
H. + C2H6 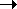 H2 + C2H5.
H2 + C2H5.
H. + C2H5. 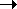 C2H6 C2H6
Покажите, что скорость образования этилена
описывается уравнением первого порядка, если
константа скорости первой реакции мала.
3. Начальная скорость выделения O2 при
действии фермента на субстрат была измерена для
ряда концентраций субстрата:
| [S], моль/л |
0.050 |
0.017 |
0.010 |
0.005 |
0.002 |
| V0, мм3/мин |
16.6 |
12.4 |
10.1 |
6.6 |
3.3 |
Определите константу Михаэлиса данной реакции.
4. Изомеризация диизопропилового эфира в
аллилацетон в газовой фазе представляет собой
реакцию первого порядка, константа скорости
которой (в с-1) зависит от температуры
следующим образом:
 . .
Используя теорию активированного комплекса,
рассчитайте энтальпию и энтропию активации при
температуре 400 оС.
5. Эквивалентная электропроводность раствора
гидроксида этиламмония C2H5NH3OH
при бесконечном разведении равна 232,6 См. см2.
моль-1. Рассчитайте константу
диссоциации, эквивалентную электропроводность
раствора, степень диссоциации и концентрацию
ионов гидроксила в растворе при разведении 16 л.
моль-1, если удельная электропроводность
раствора при данном разведении равна 1,312 См.
см-1.
6. В гальваническом элементе при температуре 298
К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag.
Рассчитайте изменение энтропии реакции, если
стандартная э.д.с. элемента Eo
= 0,6753 В, а стандартные энтальпии образования CdCl2 и AgCl
равны –389,7 и –126,9 кДж. моль–1
соответственно.
7. Используя первое приближение теории
Дебая-Хюккеля, рассчитайте коэффициенты
активности ионов Ca2+, Cl– и средний
ионный коэффициент активности в 0,002 моль. л-1
растворе CaCl2 при 25 o C.
Биологический факультет
Экзамен по физической химии (4-й
семестр)
1. Дана реакция nA 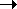 B.
Отношение времен превращения A на кратную часть
равно B.
Отношение времен превращения A на кратную часть
равно  1/2 / 1/2 /  1/3 = 2. Определите
порядок реакции n. 1/3 = 2. Определите
порядок реакции n.
2. Реакция разложения вещества А может
протекать параллельно по трем направлениям:

Концентрации продуктов в смеси через 10 мин
после начала реакции были равны: [B] = 1.6 моль/л, [C] =
3.6 моль/л, [D] = 7.8 моль/л. Определите константы
скорости k1 – k3, если период
полураспада вещества А равен 8 мин.
3. В некоторых случаях кинетические
исследования ферментативных реакций проводят в
условиях избытка фермента. Выведите уравнение
Михаэлиса-Ментен, описывающее зависимость начальной
скорости ферментативной реакции от начальных
концентраций фермента и субстрата в системе

при условии, что концентрация фермента намного
превышает концентрацию субстрата.
4. Реакция 1-го порядка при температуре 70 оС
завершается на 40% за 60 мин. При какой температуре
реакция завершится на 80% за 120 мин, если энергия
активации равна 60 кДж/моль?
5. В гальваническом элементе обратимо протекает
реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитайте  H и H и  S реакции, если э.д.с. элемента равна
1,0960 В при 273 К и 1,0961 В при 276 К. S реакции, если э.д.с. элемента равна
1,0960 В при 273 К и 1,0961 В при 276 К.
6. Удельная электропроводность 0,135 моль. л-1
раствора пропионовой кислоты C2H5COOH
равна 4,79. 10-2 См. м-1.
Рассчитайте эквивалентную электропроводность
раствора, константу диссоциации кислоты и pH
раствора, если предельные подвижности H+ и C2H5COO–равны
349,8 См. см2. моль-1 и 37,2 См.
см2. моль-1, соответственно.
7. Рассчитайте активность электролита a и
среднюю ионную активность a в 0,2 m растворе AlCl3 при 25 o
C, если в 0,2 m растворе AlCl3 при 25 o
C, если   = 0,305. (m - моляльность). = 0,305. (m - моляльность).
| 
