1. Фенолы
1.1. Введение
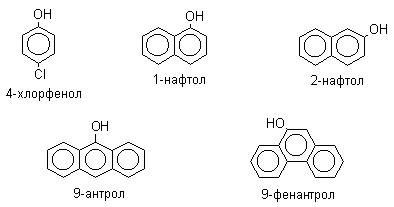
Фенолами называются соединения, у которых гидроксильная группа присоединена непосредственно к ароматическому кольцу бензола. Соединения, содержащие гидроксильную группу у конденсированных ароматических соединений, называют нафтолами, фенантролами, антролами и т.д., например:

Номенклатура фенолов проста и не требует комментариев.
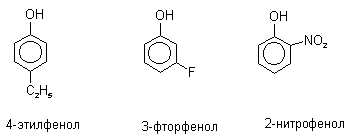
При наличии нескольких заместителей начало нумерации определяет гидроксильная группа и эти соединения рассматриваются как производные фенола. Многие фенолы имеют тривиальные названия (указанные в скобках), которые сохраняются и в систематической номенклатуре:
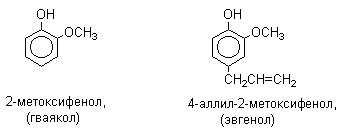
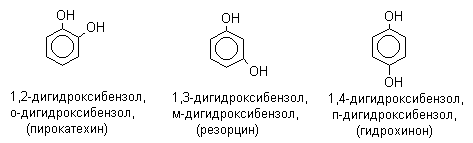
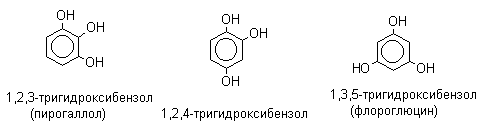
2. Получение фенолов
2.1. Замещение сульфогруппы на гидроксил
Фенол в небольшом количестве выделяют из каменноугольной смолы,однако коксохимическое производство не может удовлетворить потребности химической промышленности в феноле. Наиболее старый промышленный метод получения фенолов заключается в сплавлении щелочных арилсульфонатов с твердым гидроксидом натрия или гидроксидом калия или со сравнительно легкоплавкой смесью этих гидроксидов при 300-350оС.
![]()
![]()
Этот метод принято называть щелочным плавлением сульфонатов. Хотя точный механизм реакции в расплаве двух ионных соединений неизвестен, ее следует отнести к процессам нуклеофильного ароматического замещения, где гидроксид-ион играет роль нуклеофильного агента, а сульфит-ион - уходящей группы.
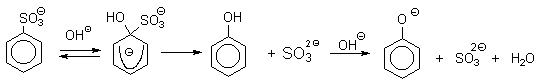
При щелочном плавлении бензолсульфоната натрия, меченного атомом углерода I-14C, установлено, что гидроксильная группа вступает к тому же атому углерода, у которого находилась сульфогруппа. Это исключает механизм с участием дегидробензола в качестве интермедиата нуклеофильного замещения. Подтверждением этому служит образование исключительно 4-метилфенола из п-толуолсульфокислоты.
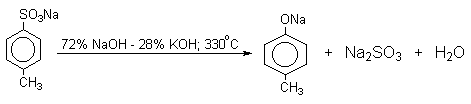
Для получения самого фенола метод щелочного плавления в настоящее время не используется, но он широко используется для получения 2-нафтола , резорцина, ализарина и других фенолов.

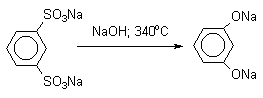
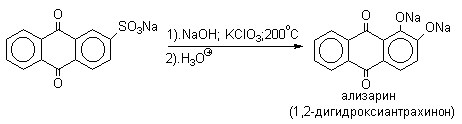
2.2.Замещение галогена на гидроксил
Вслед за щелочным плавлением арилсульфонатов был предложен более простой и доступный метод получения фенолов из арилгалогенидов замещением галогена на гидроксил. Арилгалогениды, не содержащие активирующих электроноакцепторных группировок, вступают в реакцию обмена в очень жестких условиях. Однако при нагревании хлорбензола с 15-20%-ным водным раствором гидроксида натрия при 360-390оС и давлении 28 мПа (280-300атм) образуется фенол. На основании экспериментов с хлорбензолом-I14C было показано, что в этих условиях реакция идет по ариновому механизму. Дегидробензол, образующийся из хлорбензола, превращается в фенол за счет присоединения гидроксид-иона, а при присоединении фенолят-иона дает смесь дифенилового эфира и анионов 2-гидроксибифенила и 4-гидроксибифенила.
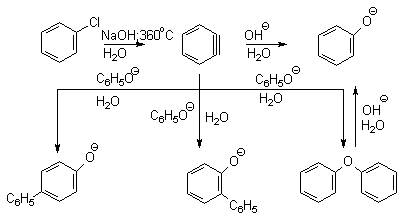
Фенолят-ионы, подобно енолят-ионам, представляют собой типичные амбидентные анионы, у которых заряд делокализован между атомом кислорода и атомами углерода в орто- и пара-положениях бензольного кольца. Образование дифенилового эфира, 2-гидрокси- и 4-гидроксибифенилов объясняется амбидентной природой фенолят-иона. Дифениловый эфир при 360-390оС в водном растворе NaOH необратимо гидролизуется в фенол. 2-Гидрокси- и 4-гидроксибифенилы в отличие от дифенилового эфира не подвергаются гидролизу, их суммарное количество среди смолообразных продуктов реакции составляет 20-25%. Из этого следует, что основным путем стабилизации дегидробензола является захват гидроксид-иона с образованием фенола. Ариновый механизм замещения хлора в неактивированных арилхлоридах на гидроксил под действием гидроксидов щелочных металлов подтверждается также образованием смеси мета- и орто-метилфенолов в соотношении 3:2 из о-хлортолуола, смеси 1- и 2-нафтолов как из 1-хлорнафталина, так и из 2-хлорнафталина. В присутствии солей меди (II), играющих роль катализатора, ариновый механизм полностью подавляется из-за резкого ускорения прямого замещения галогена по SNAr-механизму. Применение солей меди (II) позволяет проводить региоселективное замещение галогена на гидроксил без примеси кокого-либо другого изомерного фенола.
![]()
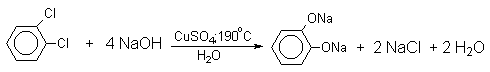
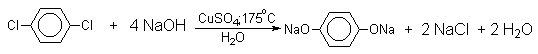
Роль ионов меди в этой реакции до настоящего времени не получила удовлетворительного объяснения.
Введение в молекулу арилгалогенида
электроноакцепторных заместителей в орто- или
пара-положения увеличивают скорость обмена
галогена на гидроксил в некатализируемой
реакции. Для такой реакции на основании
многочисленных экспериментальных данных
предложен SNAr-механизм замещения, хотя ![]() -комплекс Мейзенгеймера не был
зафиксирован в процессах обмена галогена на
гидроксил.
-комплекс Мейзенгеймера не был
зафиксирован в процессах обмена галогена на
гидроксил.
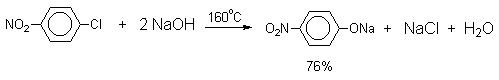
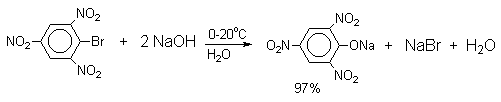
Накопление электроноакцепторных групп позволяет осуществлять замещение в очень мягких условиях, в отдельных случаях гидролиз удается провести в нейтральной среде.
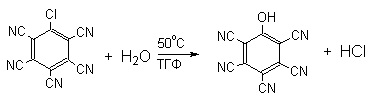
Бимолекулярный механизм присоединения-отщепления SNAr подробно изложен в методической разработке "Реакции нуклеофильного ароматического замещения" (1994, авторы: А.Л.Курц,.и др.)
2.3. Замещение диазогруппы на гидроксил
Универсальным методом замены аминогруппы на гидроксил в ароматическом ряду является диазотирование первичного амина с последующими разложением соли диазония в водном растворе серной кислоты.
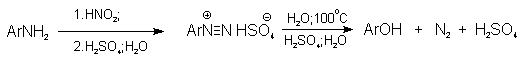
Принято считать, что замещение диазогруппы на гидроксил протекает по SN1-механизму, крайне редко реализующимуся для других реакций в ароматическом ряду. Этот механизм включает следующие стадии:
![]()
![]()
Так как образующийся на первой стадии арильный катион может реагировать с любым нуклеофилом, имеющимся в реакционной среде, наиболее целесообразно использовать для гидролиза в фенолы соответствующие гидросульфаты диазония. В качестве побочного продукта при этом образуется эфир ArOSO3H, который легко гидролизуется в фенол. Кроме того, при этом практически не наблюдаются реакции нуклеофильного ароматического замещения (SNAr), активированного N+ 2 -группой (аналогия с NO2 -группой). Наилучшие результаты для получения оптимально высокого выхода фенолов достигается при постепенном введении раствора соли диазония в кипящий раствор серной кислоты. Некоторые наиболее типичные превращения представлены следующими уравнениями:
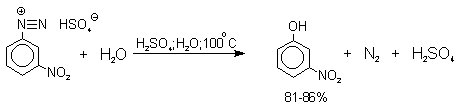
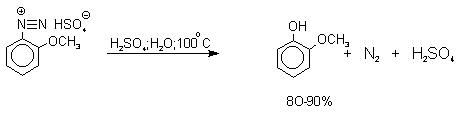
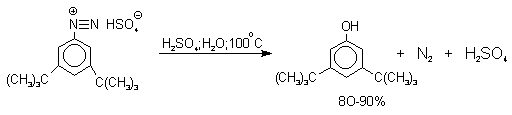
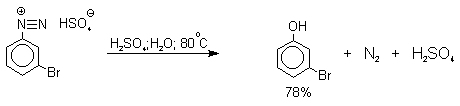
2.4. Получение фенола из гидропероксида кумола
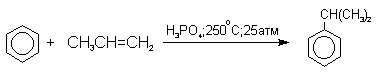
Современный промышленный метод получения фенола заключается в кислотно-катализируемом разложении гидропероксида кумола. Исходное вещество для всего цикла превращений - кумол получается в очень больших количествах при алкилировании бензола пропиленом по Фриделю-Крафтсу.
Далее кумол окисляют кислородом воздуха при 100-130оС до гидропероксида кумола.
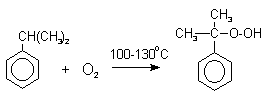
Эта реакция протекает по цепному, радикальному механизму с участием кумильного радикала. Инициатор радикального превращения отщепляет атом водорода из бензильного положения кумола с образованием достаточно стабильного третичного кумильного радикала. Этот радикал далее реагирует с кислородом с образованием нового перекисного радикала, который отщепляет атом водорода от исходного кумола с регенерацией кумильного радикала.
![]()
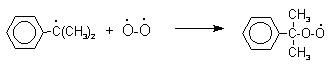
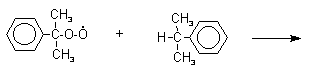
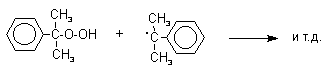
Третья, заключительная стадия всего процесса, по своему механизму напоминает перегруппировки карбкатионов. Различие заключается в том, что миграция фенила происходит к положительно заряженному атому кислорода.
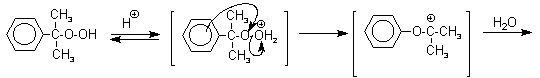
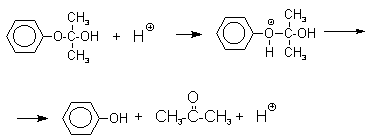
Разложение гидропероксида кумола до фенола и ацетона проводят в присутствии 1% водной серной кислоты при 50-90оС.
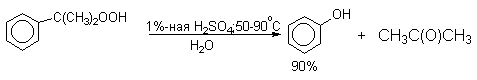
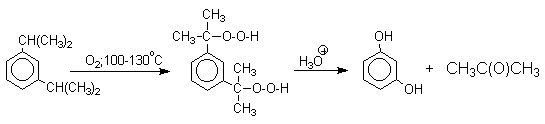
В целом это очень экономичный способ получения одновременно двух важнейших продуктов - ацетона и фенола. Аналогично в результате окисления пара- и мета-диизопропилбензолов - побочных продуктов крупнотоннажного производства кумола, образуются бисгидропероксиды. При их разложении получаются соответственно гидрохинон и резорцин.
Теоретически наиболее перспективным промышленным способом получения фенола является окисление бензола кислородом, однако до сих пор не найдено достаточно удобных и дешевых каталитических систем для этого превращения. Сравнительно низкий выход и образование побочных продуктов не позволяют рекомендовать этот способ для получения замещенных производных фенола.
Известно несколько примеров электрофильного гидроксилирования ароматических соединений под действием пероксида водорода и органических перкислот в суперкислых средах.
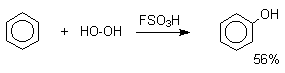
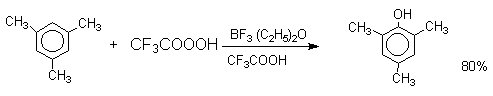
Электрофильное гидроксилирование не нашло практического применения для введения гидроксильной группы в ароматическое кольцо.