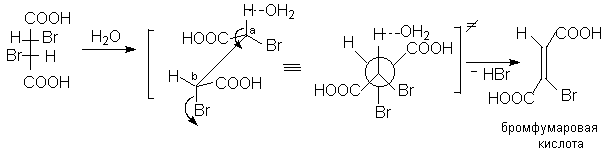
4.1.Бромфумаровая кислота.
Диастереомерные 2,3-дибромянтарные кислоты при нагревании в водном растворе легко претерпевают дегидрогалогенирование (1,2-элиминирование HBr). При этом из D,L-2,3-дибромянтарной кислоты образуется бромфумаровая кислота, а из мезо-2,3-дибромянтарной кислоты – броммалеиновая кислота.

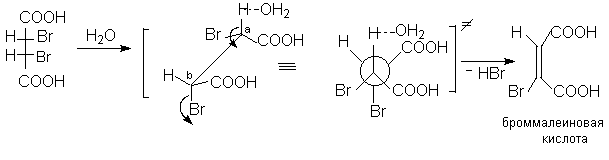
Стереоспецифичность данной реакции становится понятной, если предположить такое переходное состояние, при котором все центры, участвующие в реакции элиминирования (H,Ca,Cb и Br как уходящая группа) расположены в одной плоскости и отщепляемые атомы ( Br и H вместе с атакующим основанием) занимают анти-копланарное положение. Эти результаты основываются на постулате об одностадийном переходном состоянии реакции Е2 элиминирования.
Методика.
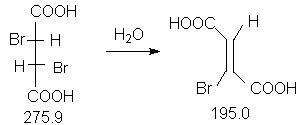
Константы исходных и синтезированных соединений. Приведены формула,т.пл.оС,т.кип.оС.
D,L-HOOC-CH(Br)-CH(Br)-COOH,166-167 ;
(C2H5)2O,-116.0, 34.5,d420
0.7138 ;
KOH, 410, 1327.0 ;
CH3COOH, 16.6, 118.0, d420 1.049 ;
Z-HOOC-CH=CBr-COOH,182-183.
Проведение синтеза.
В круглодонную колбу (100 мл) с обратным холодильником (прибор 1) помещают 5.5 г(0.02 моля) D,L-2,3-дибромянтарной кислоты и 50 мл воды. Образующуюся суспензию нагревают при кипении в течение трех часов.
Обработка реакционной смеси.
После охлаждения прозрачный раствор экстрагируют эфиром (2х50 мл), водную фазу насыщают хлоридом натрия и экстрагируют 50 мл эфира. Обьединенные эфирные вытяжки сушат сульфатом магния в течение 30 минут. Осушитель отфильтровывают, растворитель отгоняют при атмосферном давлении и остаток кристаллизуется. Определяют выход и температуру плавления кристаллов.
Очистка.
Полученный продукт перекристаллизовывают из 5 мл ледяной уксусной кислоты.После фильтрования получают бесцветные кристаллы, которые сушат в вакуум-эксикаторе над КОН. Выход 3.10 г(80 %), т.пл. 182-183оС.
Примечание:~150 мл эфира,собранного при отгонке, могут быть очищены перегонкой и вновь использованы в синтезе.
Отходы безвредные, подлежат сбросу в канализацию : ~ 50 мл водной фазы (NaCl, NaBr).
Отходы, требующие утилизации : использованный осушитель,5 мл маточного раствора ледяной уксусной кислоты.
Методы обработки реакционной смеси : 2.1, 2.2, 2.3.
Выделение полученного соединения : 3.1, 3.2.
4.2. Броммалеиновая кислота.
Методика.
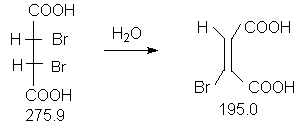
Константы исходных и полученного соединений. Приведены формула, т.пл.оС. т.кип.оС, d420:
мезо -HOOC-CH(Br)-CH(Br)-COOH,256-257 ;
(C2H5)2O, -116.0, 34.5, 0.7138 ;
CH3COOC2H5, -84.0, 77.0, 0.9010 ;
CH3C6H5, -95.0, 110.8, 0,8669 ;
петролейный эфир, -, 40-80 ;
циклогексан, 6.5, 80.8, 0.7786 ;
E-HOOC-CH=CBr-COOH, 133.
Проведение синтеза.
В приборе (прибор 1) суспензируют 5.5 г(20.0 ммоль) мезо-2,3-дибромянтарной кислоты в 50 мл воды и нагревают 3 часа с обратным холодильником.
Обработка реакционной смеси.
После охлаждения прозрачный растор экстрагируют эфиром (2х50 мл), насыщают водную фазу хлоридом натрия и снова экстрагируют 50 мл эфира. Обьединенные эфирные вытяжки сушат в течение 30 минут сульфатом магния, отфильтровывают от осушителя и отгоняют растворитель при атмосферном давлении. Остаток – кристаллическая масса. Определяют выход и его температуру плавления.
Очистка.
Для перекристаллизации используют этилацетат (не более 0.5 мл растворителя на 1 г неочищенного продукта). К горячему раствору добавляют 1 каплю толуола и циклогексан (по 0.5 мл на 1 г неочищенного продукта) и оставляют на ночь в холодильнике. Выпавшие кристаллы отфильтровывают на стеклянном фильтре, промывают небольшим количеством петролейного эфира и получают 3.0 г (77 %) бесцветных кристаллов с температурой плавления 133оС.
Примечание: Отогнанный в процессе синтеза эфир( ~ 150 мл) очищают перегонкой и снова используют в синтезе.
Отходы безвредные, подлежат сбросу в канализацию : ~50 мл водной фазы (NaBr, NaCl).
Отходы, подлежащие утилизации : использованный осушитель, ~ 10 мл маточного раствора (при перекристаллизации).
Методы обработки реакционной смеси : 2.1, 2.2, 3.2, 3.4.
Выделение полученного продукта: 3.1, 3.2.
5.1. 4-Метоксиацетофенон.
Ацилирование по Фриделю-Крафтсу служит удобным методом введения ацильной группы в ароматическое ядро, что приводит к образованию арилзамещенных кетонов. В качестве ацилирующих агентов чаще всего используются ацилгалогениды или ангидриды кислот в присутствии кислот Льюиса (чаще всего AlCl3).
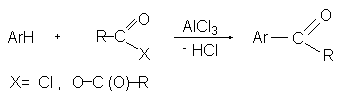
При ацилировании в отличие от алкилирования используют стехиометрические количества кислот Льюиса, поскольку катализатор уходит из реакции, образуя комплекс с продуктом реакции кетоном. Электрофильным агентом в реакции ацилирования ароматических соединений является либо донорно-акцепторный комплекс (I), либо катион ацилия (II), образующийся при его диссоциации.
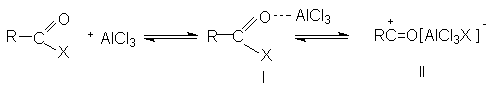
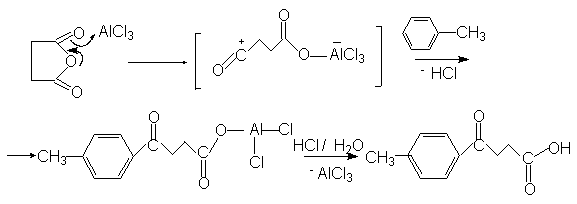
Существенным преимуществом ацилирования аренов по сравнению с алкилированием является то, что ароматическое ядро в этой реакции не подвергантся ди- и полизамещению. Это обьясняется тем, что ацильная группа является электроноакцепторным заместителем и понижает реакционную способность исходного арена в реакциях электрофильного замещения. В реакции ацилирования в качестве субстратов могут быть арены, алкил-,алкокси- и галогенарены. Арены, содержащие заместители II-рода не вступают в реакцию Фриделя-Крафтса. Так, нитробензол часто используют в этой реакции в качестве растворителя. Было доказано, что при ацилировании реакционноспособных аренов препаративно более удобным является использование ангидридов кислот по сравнению с ацилгалогенидами. В случае монозамещенных аренов ацилирование осуществляется преимущественно в пара-положение, вследствие стерических затруднений. Использование в качестве ацилирующего агента ангидрида янтарной кислоты приводит к образованию арилзамещенных g-кетокислот ( см. синтез b-(4-метилбензоил)пропионовой кислоты).
![]() -Ароилалкилкарбоновые
кислоты после восстановления кетогруппы до
метиленовой и последующего внутримолекулярного
ацилирования циклизуются с образованием
тетралонов и суберонов.
-Ароилалкилкарбоновые
кислоты после восстановления кетогруппы до
метиленовой и последующего внутримолекулярного
ацилирования циклизуются с образованием
тетралонов и суберонов.
Методика.
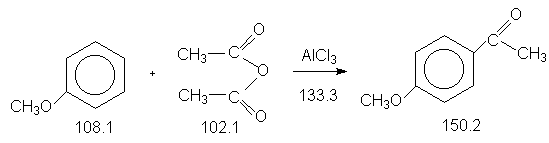
Константы исходных и синтезированных соединений. Приведены формула, т.пл.оС, т.кип.оС:
(CH3CO)2O,-73.0, 140.0, d420
1.08 ;
AlCl3 безводный, 190 ;
Cl2C=CHCl,-73.0, 87.0, d420 1.46 ;
NaOH, 319.0, 1390 ;
CH3O-C6H5, -37.0, 153.0,d420
0.995 ;
HCl (газ), -114.8, -85.0;
4-CH3O-C6H4COCН3, 39.0,
265.0.
Проведение синтеза.
В трехгорлую колбу, снабженную механической мешалкой, обратным холодильником (с газоотводной трубкой) и капельной воронкой (тяга !) (прибор 3 ) помещают 27.0 г (0.25 моля) анизола, 100 мл сухого трихлорэтилена и 73.3 г (0.55 моля) безводного хлористого алюминия. При интенсивном перемешивании добавляют 25.5 г( 0.25 моля) уксусного ангидрида в течение 15 минут. Происходит саморазогревание реакционной смеси с выделением хлористого водорода. Колбу нагревают на кипящей водяной бане в течение 30 минут до прекращения выделения газа.
Обработка реакционной смеси.
После охлаждения содержимое колбы выливают в стакан с 500 г льда. Отделяют образующийся органический слой и встряхивают в делительной воронке со 100 мл воды, затем с 10 %-ным раствором гидроксида натрия (100 мл) и опять с водой (100 мл). Органическую фазу отделяют и высушивают хлоридом кальция.
Очистка.
Растворитель отгоняют на кипящей водяной бане. Остаток перегоняют в вакууме с воздушным холодильником (прибор 12). 4-Метоксиацетофенон получают в виде бесцветной жидкости с т.кип. 139оС / 15 мм Hg, которая затвердевает при потирании стеклянной палочкой, т.пл. 38-39оС. Выход 28.2 г(75 %). Полученный продукт используют для синтеза 4-метоксибензойной кислоты. Трихлорэтилен, отогнанный из реакционной смеси, очищают перегонкой и снова используют в синтезе.
Отходы безвредные ,сбрасывают в канализацию :~300 мл промывных вод.
Отходы, подлежащие обезвреживанию :~ 500 мл водной фазы, использованный осушитель, предгон и остаток после перегонки.
Методы обработки реакционной смеси : 2.1, 2.2.
Выделение полученного соединения : 3.4.
5.2. ![]() -(4-Метилбензоил)пропионовая
кислота.
-(4-Метилбензоил)пропионовая
кислота.
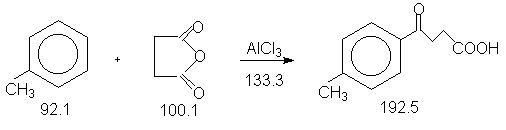
Константы исходных и полученного соединений. Приведены формула, т.пл.оС, т.кип.оС.
Ангидрид янтарной кислоты,119.5, 261.0 ;
AlCl3 безводный,190, - ;
CH3C6H5, -95.0, 110.8, d420
0.87 ;
CH2Cl2, -95.0, 40.0, d420
1.46 ;
петролейный эфир,-, 40-80 ;
4-CH3C6H4CO(CH2)2COOH,
126-127.
Проведение синтеза.
В трехгорлую колбу (500 мл), снабженную механической мешалкой, обратным холодильником с газоотводной трубкой (тяга !) помещают 50 г сухого толуола и 10.0 г(0.10 моля) ангидрида янтарной кислоты. При перемешивании через третье горло, закрытое пробкой на шлифе, порциями вносят 15.0 г тонкоизмельченого хлорида алюминия. Реакционную смесь энегрично перемешивают,чтобы предотвратить спекание AlCl3, при температуре 60оС в течение 1 часа.
Обработка реакционной смеси.
При интенсивном перемешивании к темно-зеленой реакционной смеси последовательно добавляют 100 мл ледяной воды и около 50 мл конц. соляной кислоты для растворения выпавшей соли алюминия. После в колбу добавляют 75 мл хлористого метилена и переносят реакционную смесь в делительную воронку. После энергичного встряхивания отделяют органическую фазу. Водную фазу экстрагируют 25 мл хлористого метилена и обьединенные органические вытяжки сушат сульфатом натрия. Отфильтровывают осушитель и раствор упаривают на роторном испарителе примерно до 1/5 первоначального обьема.
Очистка.
Полученный продукт выпадает в виде кристаллов после добавления 25 мл петролейного эфира и полная кристаллизация завершается после охлаждения в течение 20-ти минут в бане со льдом. Кристаллы отфильтровывают на стеклянном фильтре и промывают петролейным эфиром. После упаривания маточного раствора на роторном испарителе до обьема 25 мл и смешивания его с 25 мл бензола можно выделить еще некоторое количество кристаллов. Получают 14.0 г(72 %) кристаллического продукта в виде бесцветных призм, т.пл 126-127оС.
Примечание: Полученный продукт является исходным соединением для синтеза 4-(п-толил)-4-гидроксимасляной кислоты (см. далее);
~100 мл хлористого метилена могут быть собраны, очищены перегонкой и вновь использованы в синтезе.
Отходы подлежащие утилизации :~ 150 мл кислой водной фазы, осушитель,~ 75 мл смеси толуола и петролейного эфира.
Методы обработки реакционной смеси : 2.1, 2.2, 2.3.
Выделение полученного соединения : 3.2.