|
Кафедра неорганической химии
Учебные материалы по неорганической химии
[предыдущий раздел] [содержание] [следующий
раздел]
§ 15. Оксогалогениды.
Среди тионилгалогенидов известны SOF2 ,
SOCl2, SOBr2. Аналогичные соединения
получены у Se. SOF2 и SOCl2 представляют
собой бесцветные легко летучие жидкости.
Соединения Se обладают более высокими
температурами плавления и кипения. Молекулы ЭOХ2
характеризуются пирамидальным строением с
неподеленной электронной парой, направленной от
плоскости ОХ2 (рис.12).
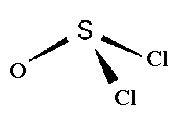
Рис.12.Пространственное строение
молекулы тионилхлорида SOCl2.
Практически важен тионилхлорид SOCl2.
Его получают в промышленном масштабе
взаимодействием SO3+SCl2 SOCl2+SO2. В
лаборатории тионилхлорид с хорошим выходом
образуется при хлорировании SO2 с помощью PCl5:
PCl5 + SO2 SOCl2+SO2. В
лаборатории тионилхлорид с хорошим выходом
образуется при хлорировании SO2 с помощью PCl5:
PCl5 + SO2  SOCl2 + OPCl3 .
SOCl2 + OPCl3 .
Соединения ЭOХ2 быстро разлагаются водой:
ЭОХ2+Н2О  ЭO2+2HХ с образованием двух кислот и поэтому
является галогенангидридами Э(IV) кислоты. На этой
реакции основано использование SOCl2 в
качестве эффективного осушителя и для получения
безводных хлоридов металлов: AlCl3 . 6H2O
+ 6SОCl2
ЭO2+2HХ с образованием двух кислот и поэтому
является галогенангидридами Э(IV) кислоты. На этой
реакции основано использование SOCl2 в
качестве эффективного осушителя и для получения
безводных хлоридов металлов: AlCl3 . 6H2O
+ 6SОCl2  AlCl3
+ 12HCl + 6SO2. AlCl3
+ 12HCl + 6SO2.
Выше температуры кипения (76оС) SОCl2
распадается на S2Cl2, SO2 и Cl2,
благодаря чему служит хлорирующим и окисляющим
реагентом. Помимо этого, тионилхлорид, как и SeOCl2,
используется в качестве ионизирующего неводного
растворителя.
Подобно оксогалогенидам халькогенов (IV),
оксогалогенидные производные серы, селена и
теллура SО2X2, SeO2X2 и TeO2F2
представляют собой химически активные
соединения и в обычных условиях существуют в
виде бесцветных летучих жидкостей или газов.
Наиболее важное из них соединение, сульфурилхлорид
SO2Cl2, синтезируют в промышленном
объеме прямым хлорированием SO2 в
присутствии катализатора: SO2+Cl2  SO2Cl2.
Соединение устойчиво до 300оС и затем
диссоциирует на SO2 и Сl2. Благодаря
этому, используется в качестве хлорирующего и
окислительного реагента. SO2Cl2.
Соединение устойчиво до 300оС и затем
диссоциирует на SO2 и Сl2. Благодаря
этому, используется в качестве хлорирующего и
окислительного реагента.
SО2Cl2 может рассматриваться как
хлорангидрид серной кислоты:
SO2Cl2 + 2 H2O  H2SO4 + 2HCl . H2SO4 + 2HCl .
Молекулы SО2X2 представляют собой
искаженные тетраэдры с находящимися внутри них
атомами серы и с углами O- S- O, близкими к 120о
(120-126о).
[предыдущий раздел] [содержание] [следующий
раздел]
Список литературы
Основная литература
1. Ахметов Н.С. Общая и неорганическая химия. М.,
Высшая школа, 1988. 2.Спицын В.И. Мартыненко Л.И.
Неорганическая химия. Часть 1. М., МГУ, 1991.
3.Коттон Ф., Уилкинсон Дж. Современная
неорганическая химия. М., Мир, т.2, 1969.
4.Турова Н.Я. Справочные таблицы по
неорганической химии. М., Химия, 1997.
5.Семинары по неорганической химии. 1-ый семестр.
Учебное пособие. М., Химфак МГУ, 1996.
6.Практикум по неорганической химии. Под ред.
Зломанова В.П. Издание 3-е. М., МГУ, 1994.
Дополнительная литература
Д1. Grenwood N.N., Earnshaw A. Chemistry of the elements. Pergamon Press. 1984.
Д2. Хьюи Дж. Неорганическая химия. М., Химия, 1987.
Д3. Дж.Эмсли. Элементы. М., "МИР", 1993, с.86-87,172-176,
188-189.
Д4. Gmelins Handbuch fur Anorganische Chemie. V. "Schwefel".
Д5. Shriver D.F., Atkins P.W., Langford C.H. Inorganic Chemistry. Oxford University
Press. 1994.
[предыдущий раздел] [содержание] [следующий
раздел]
|

