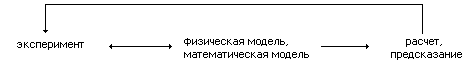
Введение. Химическая физика, химическая кинетика, химическая динамика
Изучение механизмов и скоростей химических превращений относят к области науки, которая лежит на пересечении традиционных химии и физики. Сюда относят физическую химию, химическую физику, химическую кинетику и химическую динамику. Эти разделы нашего знания не имеют четких границ, однако приближенно можно сказать, что физическая химия и химическая физика связаны с применением физических методов и физических теорий для изучения и описания химических реакций. Химическая кинетика - это, в первую очередь, наука о скоростях и механизмах химических превращений в ансамблях частиц, а химическая динамика занимается изучением поведения индивидуальных частиц в ходе химического превращения. Надо отметить, что кинетический подход, т.е. рассмотрение процессов с точки зрения их скоростей, - один их важнейших инструментов химического исследования. Целью применения этого подхода, как правило, является выяснение механизма изучаемого химического процесса.
Рассмотрим последовательность стадий исследования, которая характерна для этой области науки в целом, и для химической кинетики в частности.
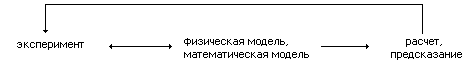
Первая стадия исследования - эксперимент, в ходе которого измеряются и регистрируются характеристики изучаемого процесса - концентрации исходных, промежуточных и конечных веществ, скорости и константы скоростей реакций, влияние на процесс внешних воздействий (изменения температуры, растворителя, облучения светом и т.п.).
Вторая стадия кинетического исследования - создание физической, а затем и математической модели. В ходе этой стадии исследователь определяет набор параметров и переменных, которые в достаточной степени описывают изучаемое явление, выбирает физические процессы, которые в совокупности объясняют поведение системы, наблюдающееся в эксперименте, и по возможности предлагает математические выражения, количественно описывающие исследуемое явление. Эта стадия называется "обратной кинетической задачей".
Остановимся на этой стадии несколько подробнее, поскольку решение обратной задачи вызывает наибольшие трудности, именно с ней связано большое число ошибок в кинетическом исследовании. Разработка модели и даже правильный выбор переменных и характеристик изучаемого процесса являются творческой задачей, для решения которой используются интуиция, опыт, фантазия, аналогии и т.п. Именно с этой стадией исследования связаны наиболее крупные достижения в науке, когда многообразные и внешне разнородные наблюдения объясняются и объединяются в рамках одной гипотезы. К сожалению, не существует алгоритмов и рецептов правильного решения обратной задачи. Можно лишь сказать, что к этой стадии исследования относится одно из основополагающих правил естествознания ("бритва Оккама"), которое требует использовать при построении гипотезы наименьший набор самых простых предположений. Трудности решения обратной задачи приводят к тому, что чаще всего исследователи используют не оригинальные гипотезы, а модели, разработанные до них. Именно отсутствие адекватных моделей приводит, например, к тому, что при описания заведомо неэлементарных реакций используются понятия константы скорости реакции, энергии активации и т.п.
Третья стадия кинетического исследования - расчет экспериментального поведения системы на основе имеющейся модели - имеет название "прямая кинетическая задача". Результаты расчета затем сравниваются с результатами имеющегося или нового эксперимента. В ходе такого сравнения проверяется жизнеспособность принятой гипотетической модели.
В курсе лекций приведены лишь самые простые примеры решения обратной кинетической задачи. Это примеры, в которых структура и суть модели известны, и необходимо лишь определить количественные параметры, входящие в модель. Даже эта ограниченная формулировка обратной задачи не всегда имеет однозначное решение. Самая большая часть курса посвящена рассмотрению имеющихся моделей протекания химического превращения и методов решения прямой кинетической задачи на основе этих моделей.
Прежде, чем приступить к обсуждению конкретных моделей, отметим следующее. На вопрос: "Зачем нужна теория вообще и теория элементарного акта химической реакции?", как правило, следует ответ: "Для того, чтобы рассчитать теоретически скорость (константу скорости) нужной реакции". Этот ответ не полон, а неполная правда может дезориентировать больше, чем полная ложь. Действительно, теория элементарного акта химических превращений развивается уже не одно десятилетие и достигла больших успехов. Однако и сейчас теоретические расчеты констант скорости произведены для ничтожной части гигантского разнообразия химических превращений. Даже при современных вычислительных возможностях расчет константы скорости сколько-нибудь интересной реакции является очень непростой, дорогой, трудоемкой и в большинстве случаев ненадежной процедурой. Однако значение теории заключается не только и не столько в разработке вычислительных процедур, но и в не меньшей степени в разработке понятий, терминов и представлений, которые качественно отражают закономерности протекания химических реакций. Эти термины и представления являются совершенно необходимым инструментом мышления исследователя. В связи с этим, в настоящем курсе мы не будем углубляться в детали вычислительных процедур и вывод нужных для этого формул, имея в виду, что заинтересованный в них читатель может воспользоваться соответствующей специальной литературой. Выводы формул будут приводиться лишь в тех случаях и в той мере, в которой они иллюстрируют основные методы, подходы и принципы соответствующих теорий. В большинстве случаев мы ограничимся лишь приближенными выражениями, которые иллюстрируют особенности рассматриваемых моделей. Основное внимание будет уделено физической сущности изучаемых явлений, обсуждению достоинств и ограничений рассматриваемых моделей и способам их использования для описания эксперимента.
Несмотря на гигантское разнообразие известных веществ и еще большее число реакций, в которые они вступают, обычно рассматривается очень ограниченный круг элементарных химических превращений. Большинство реакций может быть рассмотрено, как совокупность следующих элементарных актов:
1. Реакция диссоциации/рекомбинации:
![]()
![]()
2. Реакция обмена (замещения):
![]()
3. Реакция переноса электрона:
![]()
4. Реакция переноса протона:
![]()
5. Реакция изомеризации.
Приведенный список не является однозначным. В частности, реакция переноса протона может рассматриваться как реакция обмена заряженной частицей - протоном. Реакция изомеризации не может быть выражена обобщающим уравнением, несмотря на то, что процессы цис-транс изомеризации, миграции групп, валентной изомеризации, циклизации и т.д. имеют некоторые общие черты при рассмотрении их элементарного акта.
В настоящем курсе в большей или меньшей степени будут рассматрены именно указанные элементарные реакции.