Ковалентная связь образуется за счет
перекрывания электронных облаков связываемых
атомов. Существуют разные способы перекрывания
этих электронных облаков.
1. Прямое перекрывание:
В этом случае единственная область
перекрывания электронных облаков лежит на
прямой, соединяющей ядра атомов. Связь,
образованная таким образом, называется  -связью.
-связью.
2. Боковое перекрывание:
В этом случае две области перекрывания
электронных облаков находятся по разные стороны
от плоскости, в которой лежат ядра связываемых
атомов. Связь, образованная при таком
перекрывании ЭО, называется  - связью.
- связью.
Как и в случае  -связи, в
зависимости от вида перекрывающихся облаков
могут образоваться различные разновидности
-связи, в
зависимости от вида перекрывающихся облаков
могут образоваться различные разновидности  -связи:
-связи:  p-p,
p-p,  p-d,
p-d,
 d-d и т. п.
d-d и т. п.
7.9. Энергия ковалентной связи
Прочность связи характеризуется энергией
связи (см. параграф 7.5). Прочность ковалентной
связи можно оценить двумя способами: определив
энергию, необходимую для разрыва всех связей в
определенной порции вещества, или определив
энергию, необходимую для разрыва известного
числа связей. В первом случае такая энергия
называется энергией атомизации, во втором –
энергией связи. На практике используют
соответствующие молярные величины.
| Молярная энергия атомизации (Еат)
– отношение энергии, затрачиваемой на
разделение порции молекул вещества на
изолированные атомы, к количеству вещества в
этой порции. |
Молярная энергия атомизации показывает, какую
энергию нужно затратить на разделение 1 моля
вещества на изолированные атомы.
| Молярная энергия связи (Есв) –
отношение энергии, затрачиваемой на разрыв
определенного числа связей, к числу этих связей,
измеренному в молях. |
Молярная энергия связи показывает, какую
энергию нужно затратить на разрыв 1 моля (6,02.1023)
связей. Для двухатомных молекул эти энергии
совпадают.
И ту, и другую молярную энергию измеряют в
килоджоулях на моль: в случае энергии атомизации
– на моль вещества, а в случае энергии связи – на
моль связей. При подсчете числа связей для
определения Есв двойную (или тройную) связь
считают одной связью.
Таблица 21.Примеры значений Еат
и средних значений Есв (в кДж/моль)
Вещество |
Еат |
Вещество |
Еат |
Связь |
Есв |
Связь |
Есв |
| H2 |
436 |
HF |
566 |
C– H |
411 |
N=O |
678 |
| F2 |
159 |
HCl |
432 |
N– H |
390 |
C– C |
348 |
| Cl2 |
392 |
HBr |
366 |
O– H |
428 |
C=C |
614 |
| Br2 |
194 |
HI |
298 |
Si– H |
326 |
Cє C |
839 |
| I2 |
153 |
CO |
1076 |
P– H |
328 |
Cє N |
891 |
| O2 |
498 |
IBr |
179 |
S– H |
347 |
Si– O |
452 |
| N2 |
945 |
ClF |
251 |
C=O |
745 |
S=O |
525 |
Из приведенных в таблице 21 значений можно
сделать вывод, что прочность ковалентных связей
тем больше, чем меньше размеры связываемых
атомов и больше кратность связи.
 МОЛЯРНАЯ
ЭНЕРГИЯ АТОМИЗАЦИИ, МОЛЯРНАЯ ЭНЕРГИЯ СВЯЗИ.
МОЛЯРНАЯ
ЭНЕРГИЯ АТОМИЗАЦИИ, МОЛЯРНАЯ ЭНЕРГИЯ СВЯЗИ.
7.10. Строение молекул. Модель
гибридизации
Большинство соединений с ковалентными связями
между атомами состоит из молекул.
Понятие " строение молекул" – довольно
широкое понятие и включает в себя, в частности,
химическое строение и пространственное
строение.
| Химическое строение молекулы –
последовательность и тип связей между атомами в
молекуле. |
Химическое строение молекулы описывается
структурной формулой.
Пространственное строение
молекулы – взаимное расположение атомов
молекулы в пространстве. |
Пространственное строение молекулы
описывается пространственной формулой.
Чтобы охарактеризовать пространственное
строение молекулы количественно, нужно
определить межатомные расстояния и углы между
связями. И то, и другое может быть определено
экспериментально.
Межатомное расстояние –
расстояние между ядрами атомов. |
Угол между связями – угол
между прямыми, проходящими через ядра атомов,
связанных ковалентными связями. |
Для оценки межатомных расстояний в молекулах
веществ, пространственное строение которых еще
не изучено, часто используют так называемые
атомные (ковалентные) радиусы.
Атомный радиус – половина
расстояния между атомами, связанными простой
связью, в молекуле или кристалле простого
вещества. |
Сумма атомных радиусов атомов разных элементов
равна среднему расстоянию между атомами этих
элементов, связанными простой ковалентной
связью, в молекулах или кристаллах. Таблица
атомных радиусов приведена в приложении 9.
Для оценки углов между связями оказывается
полезной модель гибридизации.
Вспомним химическое строение молекулы метана
(см. рис. на стр. 21). Из схемы образования
ковалентных связей в этой молекуле (стр. 105)
следует, что три из четырех связей в этой
молекуле совершенно одинаковы. Так как оси
электронных облаков p-АО взаимно
перпендикулярны, то и три ковалентных связи,
образованные с участием этих облаков, должны
быть направлены под прямым углом друг к другу.
Четвертая же связь должна от них несколько
отличаться. Экспериментально установлено, что
все четыре связи в молекуле метана совершенно
одинаковы и направлены в пространстве так, как
это показано на рисунке (стр. 21). То есть атом
углерода занимает положение в центре тетраэдра
(правильного четырехгранника, треугольной
пирамиды), а атомы водорода – в его вершинах. Это
возможно только в том случае, если электронные
облака атома углерода, участвующие в образовании
связи, совершенно одинаковы и соответствующим
образом расположены в пространстве.
В рамках модели гибридизации предполагается, что
такое выравнивание действительно происходит.
| Гибридизация атомных орбиталей и
электронных облаков – предполагаемое
выравнивание атомных орбиталей по энергии, а
электронных облаков по форме при образовании
атомом ковалентных связей. |
Подвергшиеся гибридизации АО и ЭО называют
гибридными.
В случае метана CH4 гибридизации
подвергаются одна 2s-АО и три 2p-АО атома углерода,
при этом образуются четыре sp3-гибридных АО.
Схематически это можно записать так:
1(2s-АО) + 3(2р-АО) 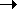 4(sp3-АО).
4(sp3-АО).
Энергии орбиталей при этом становятся
одинаковыми:
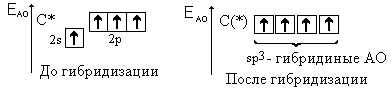
Электронные облака 2s- и 2р-орбиталей меняют свою
форму – они тоже выравниваются:
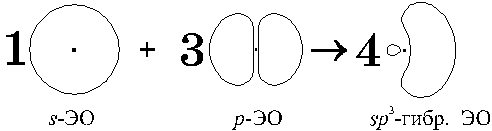
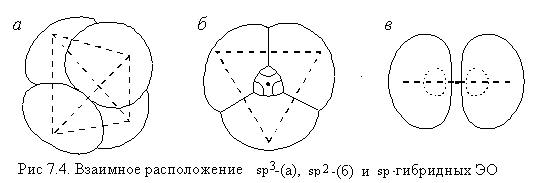
В пространстве четыре получившихся sp3-ЭО
направлены из центра к вершинам тетраэдра (рис.
7.4, а).
Гибридизации могут подвергаться и не все
р-орбитали подуровня, например:
1(2s-АО) + 2(2р-АО) 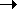 3(sp2-АО) или 1(2s-АО) + 1(2р-АО)
3(sp2-АО) или 1(2s-АО) + 1(2р-АО)  2(sp-АО).
2(sp-АО).
В этих случаях оси гибридных облаков лежат в
одной плоскости и направлены или к вершинам
равностороннего треугольника (в случае sр2-гибридизации),
или просто в разные стороны (в случае
sp-гибридизации) (рис. 7.4, б, в). Причина такого
расположения гибридных облаков – их взаимное
отталкивание.
Форма гибридных ЭО допускает только
прямое перекрывание этих облаков с облаками
других атомов, поэтому с участием гибридных АО
могут образовываться только  -связи:
-связи:  и тому подобные.
и тому подобные.
Посмотрим, как с использованием модели
гибридизации описывается пространственное
строение некоторых молекул:
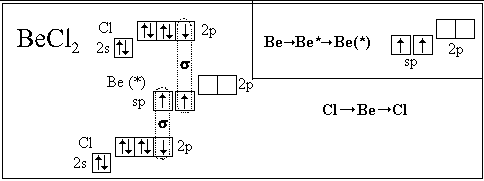
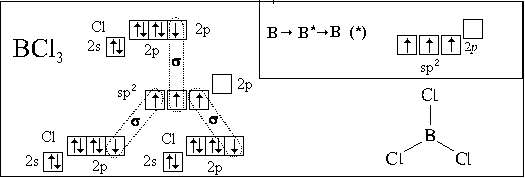
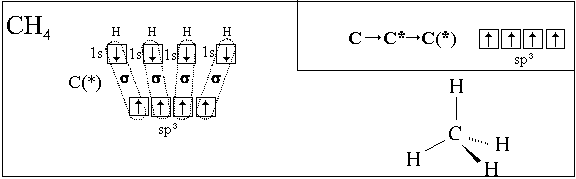
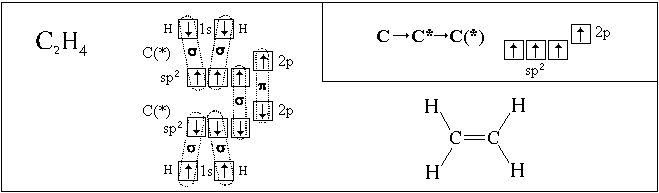
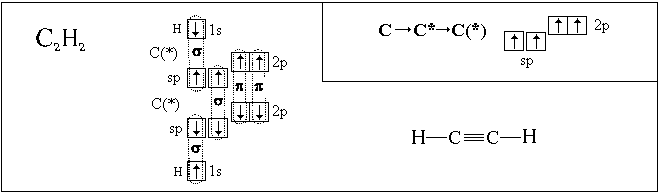
Полученные нами пространственные формулы
хорошо согласуются с экспериментальными
данными.
В приведенных примерах гибридизации
подвергались только орбитали с неспаренными
электронами. Но, если на валентных подуровнях
атома часть орбиталей полностью заполнена, эти
АО тоже участвуют в гибридизации. Так
гибридизуются валентные орбитали атома азота в
аммиаке и атома кислорода в воде.
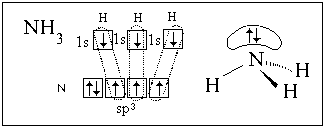
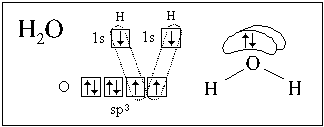
В обоих случаях у центрального атома (азота или
кислорода) sp3-гибридизация, но гибридные ЭО
неподеленных пар электронов (в пространственных
формулах не показаны малые области этих облаков)
не принимают участия в образовании связей.
Возможность такого объяснения строения молекул
аммиака и воды подтверждается значениями углов
между связями: в обеих молекулах эти углы близки
к углу в правильном тетраэдре (109o28').
Для правильного прогнозирования структуры
молекулы с помощью модели гибридизации АО
необходимо помнить следующее:
1) при образовании ковалентных связей атомами
элементов s- и р-блоков, имеющими на валентных ЭПУ
только неспаренные электроны (группы IIА, IIIА и IVА),
орбитали, на которых находятся эти электроны,
всегда гибридизуются;
2) при образовании ковалентных связей атомами
элементов р-блока, имеющими на валентных ЭПУ
кроме неспаренных электронов еще и неподеленные
пары (группы VА и VIА), гибридизация характерна
только для атомов элементов второго периода;
3) для атомов элементов IА и VIIА групп
экспериментальное подтверждение наличия или
отсутствия гибридизации невозможно;
4) если нет препятствий, осуществляется sp3-гибридизация;
если не хватает для этого валентных электронов,
или часть из них участвует в образовании  -связей, то осуществляется sp2-
или sр-гибридизация.
-связей, то осуществляется sp2-
или sр-гибридизация.
 ХИМИЧЕСКОЕ
СТРОЕНИЕ МОЛЕКУЛЫ, ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ
МОЛЕКУЛЫ, МЕЖАТОМНОЕ РАССТОЯНТЕ, УГОЛ МЕЖДУ
СВЯЗЯМИ, АТОМНЫЙ РАДИУС,ГИБРИДИЗАЦИЯ АО,
ГИБРИДНЫЕ ОРБИТАЛИ,УСЛОВИЯ ГИБРИДИЗАЦИИ АО .
ХИМИЧЕСКОЕ
СТРОЕНИЕ МОЛЕКУЛЫ, ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ
МОЛЕКУЛЫ, МЕЖАТОМНОЕ РАССТОЯНТЕ, УГОЛ МЕЖДУ
СВЯЗЯМИ, АТОМНЫЙ РАДИУС,ГИБРИДИЗАЦИЯ АО,
ГИБРИДНЫЕ ОРБИТАЛИ,УСЛОВИЯ ГИБРИДИЗАЦИИ АО .
 1.Расположите
молекулы следующих веществ в порядке
возрастания энергии связи: а) H2S, H2O, H2Te,
H2Se; б) PH3, NH3, SbH3, AsH3.
1.Расположите
молекулы следующих веществ в порядке
возрастания энергии связи: а) H2S, H2O, H2Te,
H2Se; б) PH3, NH3, SbH3, AsH3.
2.Для следующих молекул нарисуйте схемы
образования ковалентных связей и определите тип
гибридизации АО центральных атомов: а) ССl4,
OF2, NF3; б) BeI2, BF3, SiCl4; в)
H3C– CH3, HCHO, Н– С 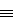 N.
N.