NO2-группы, обладающей очень сильным – М и - I эффектом, и ,во-вторых, образованием стабильного амбидентного аниона, у которого заряд делокализован между атомами кислорода и углерода.
I. АЛИФАТИЧЕСКИЕ НИТРОСОЕДИНЕНИЯ
Нитросоединения содержат функциональную
группу ![]() . Нитрогруппа относится к числу
сильнейших электроноакцепторных заместителей.
Это можно проиллюстрировать величинами рКа
некоторых нитроалканов. Так рКа
нитрометана составляет 10,2, т.е. замещение атома
водорода в метане на нитрогруппу приводит к
увеличению С - Н кислотности примерно на сорок
единиц. Для 2-нитропропана рКа составляет
7,7, т.е. по кислотности 2-нитропропан сравним с
угольной кислотой. Кислотные свойства
нитроалканов обусловлены, во-первых,
положительным зарядом на атоме азота
. Нитрогруппа относится к числу
сильнейших электроноакцепторных заместителей.
Это можно проиллюстрировать величинами рКа
некоторых нитроалканов. Так рКа
нитрометана составляет 10,2, т.е. замещение атома
водорода в метане на нитрогруппу приводит к
увеличению С - Н кислотности примерно на сорок
единиц. Для 2-нитропропана рКа составляет
7,7, т.е. по кислотности 2-нитропропан сравним с
угольной кислотой. Кислотные свойства
нитроалканов обусловлены, во-первых,
положительным зарядом на атоме азота
NO2-группы, обладающей очень сильным – М и - I
эффектом, и ,во-вторых, образованием стабильного
амбидентного аниона, у которого заряд
делокализован между атомами кислорода и
углерода.
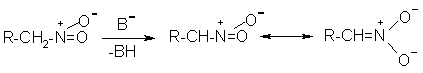
I.1.Получение нитроалканов.
Прямое нитрование алканов в жидкой или газовой фазе под действием 50-70%-ной водной азотной кислоты при 500-700оС или тетраоксида азота при 300-500оС имеет промышленное значение только для получения простейших нитроалканов, так как нитрование в этих условиях всегда сопровождается крекингом углеводородов и приводит к сложной смеси самых разнообразных нитросоединений. Эта реакция не получила по этой причине широкого распространения.
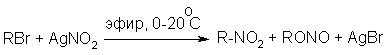
Наиболее общим лабораторным методом получения нитроалканов до сих пор остается реакция алкилирования нитрит-иона, открытая В. Мейером еще в 1872 году. В классическом методе В. Мейера нитрит серебра взаимодействует с первичными или вторичными алкилбромидами и алкилиодидами в эфире, петролейном эфире или без растворителя при 0-20 о С с образованием смеси нитроалкана и алкилнитрита.
Нитрит-ион принадлежит к числу вырожденных амбидентных анионов с двумя независимыми нуклеофильными центрами (азот и кислород), которые не связаны в единую мезомерную систему.
Реакционная способность амбидентного нитрит-иона с двумя независимыми нуклеофильными центрами (азот и кислород) резко отличается от реакционной способности енолят-ионов с двумя нуклеофильными центрами, связанными в единую мезомерную систему.
Соотношение продуктов N- и O- алкилирования (нитроалкан / алкилнитрит) в реакции Мейера алкилбромидов и иодидов с нитритом серебра решающим образом зависит от природы алкильной группы в алкилгалогениде. Выходы первичных нитроалканов достигают 75-85%, однако они резко снижаются до 15-18% для вторичных и до 5% для третичных нитроалканов.
Таким образом, ни третичные, ни вторичные
алкилгалогениды непригодны для синтеза
нитроалканов при взаимодействии с нитритом
серебра. Реакция Мейера является по-видимому
лучшим способом получения первичных
нитроалканов, арилнитрометанов и ![]() -нитроэфиров карбоновых кислот.
-нитроэфиров карбоновых кислот.
эфир, 0-20оС |
||||
| RCH2Br + AgNO2 |
|
RCH2NO2 |
+ RCH2ONO | + AgBr |
| 75-80 % | 10-20 % | |||
| эфир,0-20оС | ||||
| ArCH2Br + AgNO2 |
|
ArCH2NO2 |
+ ArCH2ONO | + AgBr |
| 40-84 % | 60-16 % | |||
| эфир,0-20о | ||||
| R-CH(Br)-COOC2H5+AgNO2 |
|
R-CH(NO2)-COOC2H5 | + AgBr |
|
75-85 % |
Для получения нитроалканов следует
использовать только алкилбромиды и алкилиодиды,
поскольку алкилхлориды, алкилсульфонаты и
диалкилсульфаты не взаимодействуют с нитритом
серебра. Из ![]() ,
,![]() -дибромалканов легко получаются
-дибромалканов легко получаются ![]() ,
,![]() -динитроалканы.
-динитроалканы.
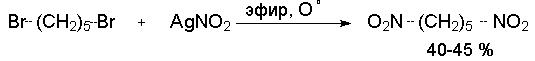
Н. Корнблюм (1955 г.) предложил модифицированный
общий метод получения первичных и вторичных
нитроалканов, а также ![]() ,
,![]() -динитроалканов и
нитрозамещенных кетонов.
-динитроалканов и
нитрозамещенных кетонов.
Этот метод основан на алкилировании нитритов щелочных металлов первичными или вторичными алкилгалогенидами в диполярном апротонном растворителе ДМФА. Для того чтобы предотвратить последующее нитрозирование нитроалкана параллельно образующимся алкилнитритом, в реакционную смесь необходимо вводить мочевину или многоатомные фенолы - резорцин или флороглюцин. Выход первичных нитроалканов по этому методу не превышает 60 %, т.е. ниже чем при алкилировании нитрита серебра (75-80%). Однако, вторичные нитроалканы можно получать с хорошим выходом алкилированием нитрита натрия в ДМФА.
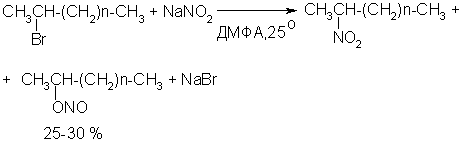
Третичные алкилгалогениды подвергаются
элиминированию под действием нитрит-иона и не
образуют нитросоединений. Эфиры ![]() -хлор- или
-хлор- или ![]() -бромзамещенных
кислот гладко превращаются в эфиры
-бромзамещенных
кислот гладко превращаются в эфиры ![]() -нитрозамещенных кислот с выходом 60-80
% при взаимодействии с нитритом натрия в ДМСО или
ДМФА.
-нитрозамещенных кислот с выходом 60-80
% при взаимодействии с нитритом натрия в ДМСО или
ДМФА.
Другой общий метод синтеза нитроалканов состоит в окислении оксимов кетонов с помощью трифторперуксусной кислоты в ацетонитриле.
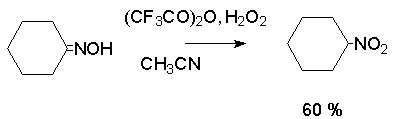
Кроме оксимов можно окислять также и первичные амины перуксусной кислотой или м-хлорпербензойной кислотой :
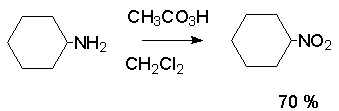
Более ста лет назад Г. Кольбе описал метод получения нитрометана при взаимодействии хлорацетата натрия и нитрита натрия в водном растворе при 80-85oС:
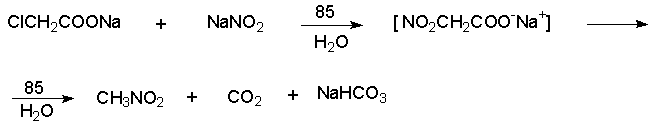
Промежуточно образующийся анион нитроуксусной
кислоты декарбоксилируется до нитрометана. Для
получения гомологов нитрометана способ Кольбе
не имеет значения из-за низкого выхода
нитроалканов. Идея этого метода была остроумно
использована при разработке современного общего
метода получения нитроалканов. Дианионы
карбоновых кислот нитруются под действием
алкилнитрата с одновременным
декарбоксилированием ![]() -нитрозамещенной
карбоновой кислоты.
-нитрозамещенной
карбоновой кислоты.
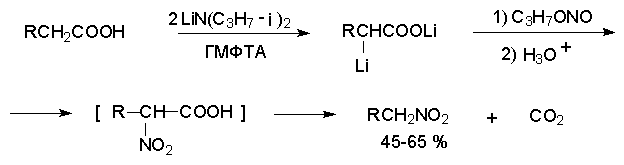
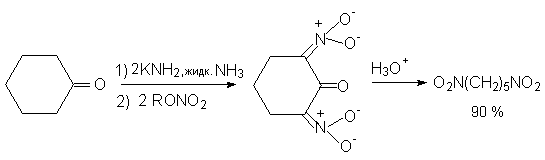
Нитрование карбанионов с помощью
алкилнитратов широко используется и для
получения ![]() ,
, ![]() - динитроалканов. С этой целью
енолят-ионы циклических кетонов обрабатывают
двумя эквивалентами алкилнитрата. Раскрытие
цикла с последующим декарбоксилированием
приводит к
- динитроалканов. С этой целью
енолят-ионы циклических кетонов обрабатывают
двумя эквивалентами алкилнитрата. Раскрытие
цикла с последующим декарбоксилированием
приводит к ![]() ,
,![]() -нитроалкану.
-нитроалкану.